UV- och synlig absorptionsspektroskopi – principer och tillämpningar
Lär dig UV- och synlig absorptionsspektroskopi: principer, elektronövergångar och praktiska tillämpningar inom forskning, kemi och materialanalys.
UV- och synlig absorption är en process där en molekyl absorberar ultraviolett eller synligt ljus vilket exciterar elektroner (gör dem energirika). Den absorberade energin driver en elektronisk övergång från ett grundtillstånd till ett exciterat tillstånd. Metoden kallas vanligen UV–vis (UV- och synlig) absorptionsspektroskopi och är en grundläggande teknik inom kemi, biokemi och materialvetenskap för både kvalitativ och kvantitativ analys.
Grundläggande principer
Elektroner i molekyler sitter i olika molekylorbitaler. När energi från ljus matchar energiskillnaden mellan två orbitaler kan en elektron övergå, exempelvis från ett bindande π-orbital till ett antibindande π* (π→π*) eller från ett icke-bindande n-orbital till π* (n→π*). Olika typer av övergångar ger upphov till absorption vid olika våglängder:
- π→π* : vanliga i konjugerade system (alkener, aromater) — ofta starka band i UV/vis.
- n→π* : svagare band, känsliga för lösningsmediets polaritet.
- d–d och charge-transfer : förekommer i övergångsmetallkomplex och ger ofta absorption i synligt område (färg).
Spektral information
- λmax — våglängden för maximal absorption; användbar för identifiering av kromoforer.
- Molar absorptivitet (ε) — ett mått på hur starkt en molekyl absorberar vid en viss våglängd (enhet M−1 cm−1).
- Bands form — breda eller smala band, vibroniska strukturer och skuggor (shoulders) kan ge information om molekylens miljö och struktur.
- Solvens- och pH-effekter kan förskjuta band (bathokromisk eller hypsochromisk förskjutning) eller ändra intensitet (hyperchromic/hypochromic effekter).
Kvantisering — Beer–Lambert lagen
Absorbansen A följer oftast Beer–Lambert lagen: A = ε · c · l, där c är koncentrationen, l är banlängden (cm) och ε molar absorptivitet. Detta gör tekniken lämplig för noggranna koncentrationsbestämningar så länge systemet är linjärt (inga koncentrationsberoende interaktioner eller ljusspridning).
Instrumentuppbyggnad
- Ljus-källa: deuteriumlampor för UV, glödtråd (tungsten) för synligt.
- Monokromator eller filter: selekterar våglängd eller smal bandbredd.
- Provcell (cuvett): kvarts för UV; glas/plast kan användas i synligt område beroende på transmissionskrav.
- Detektor: fotomultiplikator, fotodiod eller diode-array för snabb spektral registrering.
Tillämpningar
- Kvantitativ bestämning av koncentrationer i lösningar (läkemedel, miljöprover, biologiska prover).
- Övervakning av reaktioner och kinetik genom tidsupplösning av absorbansförändringar.
- Kvalitativ identifiering av kromoforer och konjugationens längd (t.ex. färgämnen, pigment).
- Studier av protein- och nukleinsyra-koncentrationer och bindningsinteraktioner.
- Analys av komplexbildning i övergångsmetallkemi (där synligt band kan avslöja ligandfältseffekter).
Praktiska råd och begränsningar
- Använd alltid ett tomt prov (blank) med samma lösningsmedel för att korrigera bakgrundsabsorption.
- Välj lämplig koncentration så att absorbansen ligger i linjärt område (ofta 0,1–1,0 A); för höga värden kräver spädning eller kortare cuvettlängd.
- Undvik ljusspridning från partiklar eller emulsioner — filtrera eller centrifiugera prover om nödvändigt.
- Komplettera med andra tekniker (IR, NMR, MS, fluorescens) när strukturell information krävs utöver elektroniska övergångar.
Sammanfattning
UV–vis absorptionsspektroskopi är en snabb, känslig och lättanvänd metod för att studera elektroniska övergångar i molekyler. Genom att analysera våglängd, intensitet och bandform får man både kvalitativ och kvantitativ information om provets sammansättning, konjugation och miljö. För bästa resultat krävs korrekt provberedning, kalibrering enligt Beer–Lambert och förståelse för vilka övergångstyper som ger upphov till de observerade banden.
Se även tekniken absorptionsspektroskopi för mer allmän bakgrund och metodrelaterade detaljer.
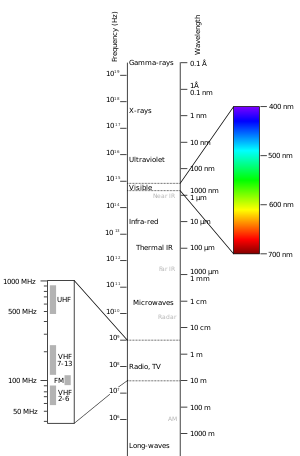
Det elektromagnetiska spektrumet
Energiupptagning
Olika molekyler absorberar olika våglängder av ljus. Ljusets våglängder för UV-absorption är från cirka 200 nanometer till 800 nanometer. Detta är en del av det avbildade elektromagnetiska spektrumet.
Absorption av ljus börjar med att energi av en viss våglängd i det UV-visuella området exponeras för en molekyl. Ljuset/energin exciterar sedan grundtillståndet (icke exciterade) yttre eller valenselektroner till ett exciterat tillstånd (hög energi). Resultatet av detta kan mätas med hjälp av en UV-siktlig spektrofotometer. Uppgifterna visas som ett spektrum med absorptionen mot våglängden. Detta mönster kan användas för att lära sig molekylens egenskaper. Endast vissa molekyler kan absorbera ljus i detta område.
Kromoforer
Molekyler som absorberar ljus vid dessa våglängder kallas kromoforer. Kromoforer är funktionella grupper i en molekyl som absorberar ljus i detta UV-visibla område. De kännetecknas oftast av delokaliserade pi-elektroner. Pi-elektroner hänvisar till en typ av bindning som uppstår mellan elektronorbitaler som kallas pi-orbitaler. När många av dessa pi-bindningar finns i en molekyl gör detta att elektroner kan vara delokaliserade eller spridda över en molekyl. Ett exempel på denna typ av molekyl visas på bilden nedan. Många färgämnen (färgade molekyler) kännetecknas av dessa delokaliserade pi-elektroner och deras färg. Dessa molekyler kan användas som pH-indikatorer för att avgöra om en lösning är sur eller basisk. Tillsats av syra eller bas stör de delokaliserade pi-elektronerna. Denna störning orsakar en färgförändring.

Lackmuspulver
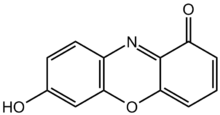
Kemisk struktur för 7-hydroxifenoxazon, kromoforen i litmuskomponenter.
Beer's Law
Absorptionen av en molekyl kan användas för att bestämma koncentrationen av molekylen i lösningen. För att bestämma koncentrationen används Beers lag. Detta är ett matematiskt förhållande som visas av ekvationen nedan.
A = a b c {\displaystyle A=abc}
A= absorption, a=absorptionskoefficient, b=patlängd, c=koncentration.
Komponenterna i Beer's Law kan bestämmas genom tester. De kan också refereras i litteraturen. Om absorptionen mäts med en UV-visible spektrofotometer (instrument för att mäta absorption och våglängd hos molekyler) är pathlängden (b) relaterad till den provbehållare som används i testet. Provbehållaren (kallad kuvett) är tillverkad av ett material som inte absorberar ljus i detta område. Tjockleken på denna kuvett är ett känt värde. Detta är den väglängd som ljuset kommer att färdas genom för att nå provet. Den molära absorptivitetskoefficienten kan beräknas genom att mäta absorptionen av ett prov med en känd koncentration och en känd pathlängd. Enheterna för absorptivitetskoefficienten är beroende av pathlängden och koncentrationsenheterna. Enheterna för molär absorptivitet är L mol-1 cm-1 när koncentrationsenheterna är molaritet. Absorptiviteten är ett mått på hur starkt en molekyl absorberar ljus vid en viss våglängd. När denna konstant har bestämts kan okända koncentrationer bestämmas utifrån detta förhållande.

Beckman DU640 UV/Vis-spektrofotometer.
Sök
