Molekyl – vad är det? Definition, struktur, bindningar och exempel
Lär dig vad en molekyl är — definition, struktur, bindningar och tydliga exempel som glukos. Enkel, begriplig förklaring för studier och nyfikna.
En molekyl är den minsta mängd av ett kemiskt ämne som kan existera. Om en molekyl delas upp i mindre bitar skulle den vara ett annat ämne.
Molekyler består av atomer som sitter ihop i en viss form. Alla kombinationer av atomer är inte lika möjliga; atomer skapar vissa former i stället för andra. De har också olika valens. Syreatomer har till exempel alltid två bindningar med andra atomer, kolatomer har alltid fyra bindningar med andra atomer och kväveatomer har alltid tre bindningar med andra atomer.
I den kinetiska teorin för gaser används ofta termen molekyl för alla gaspartiklar oavsett sammansättning. Enligt denna definition betraktas ädelgasatomer som molekyler eftersom de i själva verket är monoatomära molekyler.
I gaser som luft flyger molekylerna bara runt. I vätskor som vatten sitter molekylerna fast tillsammans men kan fortfarande röra sig. I fasta ämnen som socker kan molekylerna bara vibrera. I det fjärde materiatillståndet, som kallas plasma, är atomerna joniserade och kan inte bilda molekyler.
Med en molekylformel kan du skriva ner antalet atomer i en molekyl. Till exempel är molekylformeln för glukos C6H12O6. Det betyder att en molekyl glukos består av sex kolatomer, tolv väteatomer och sex syreatomer.
Struktur, form och geometri
Molekylers egenskaper bestäms inte bara av vilka atomer som ingår utan också av hur dessa atomer är ordnade i rummet. Elektronparen runt en atom skjuter bort varandra (en enkel bild av VSEPR‑modellen), vilket leder till typiska geometrier som:
- linjär (t.ex. CO2),
- trigonal plan (t.ex. BF3),
- tetraedrisk (t.ex. CH4),
- vinklad/böjd (t.ex. H2O).
Utöver atomernas placering pratar man om strukturformler som visar hur atomerna är bundna, och om tredimensionella modeller som visar bindvinklar och bindlängder. Vissa molekyler kan finnas i olika former (isomeri) där samma atomtyp och antal ger olika struktur och därför olika egenskaper.
Kemiska bindningar
Molekyler hålls ihop av olika typer av bindningar. De viktigaste är:
- Kovalent bindning – atomer delar elektronpar. Vanligt i organiska molekyler (t.ex. C–H, C–C, O–H). Delade elektroner skapar stabila molekyler.
- Jonbindning – elektroner överförs från en atom till en annan så att joner bildas (t.ex. NaCl). Jonföreningar bildar ofta kristallina gitter snarare än diskreta molekyler.
- Metallbindning – i metaller delas elektroner i ett “elektronhav” vilket ger god ledningsförmåga och duktilitet.
- Vätebindningar – svagare än kovalenta men viktiga intermolekylära krafter, t.ex. i vatten eller mellan DNA‑baser.
- Van der Waals‑krafter – mycket svaga krafter som verkar mellan alla molekyler och blir viktiga för stora, opolära molekyler.
Det finns också begrepp som koordinativa bindningar (där ett atompar bidrar båda elektronerna) och resonans (när flera strukturformler beskriver samma molekyl, t.ex. bensen). Modern kvantkemi beskriver bindningar med hjälp av molekylorbitaler där elektroner kan vara delokaliserade över flera atomer.
Polaritet och löslighet
Om en molekyl har ojämn fördelning av elektrontäthet blir den polar. Polära molekyler (t.ex. H2O) interagerar bra med andra polära ämnen och löser ofta varandra, medan opolära molekyler (t.ex. hexan) löser opolära ämnen. Polaritet påverkar kokpunkt, smältpunkt och hur molekyler agerar i biologiska system.
Typer av molekyler och exempel
Några vanliga exempel för att illustrera begreppen:
- Enkla diatomära gaser: H2, O2, N2 — består av två atomer.
- Vatten (H2O): vinklad molekyl, polär, bildar vätebindningar som ger många av vattnets ovanliga egenskaper.
- Koldioxid (CO2): linjär och opolär trots att bindningarna är polära, eftersom dipolerna tar ut varandra.
- Methan (CH4): tetraedrisk, grundläggande organisk byggsten.
- Stora molekyler: proteiner, DNA och polymerer — består av tusentals atomer och får komplexa tredimensionella strukturer.
- Ädelgaser (t.ex. He, Ne): monoatomära och förekommer som enskilda atomer i gasform.
Molekylformler och massa
Olika sätt att beskriva molekyler:
- Molekylformel (t.ex. C6H12O6) talar om hur många av varje atomtyp som finns i en molekyl.
- Empirisk formel anger det enklaste proportionella förhållandet mellan atomer (t.ex. CH2 för polymeren polyeten i enklare form).
- Strukturformel visar hur atomerna är bundna till varandra.
Molekylmassa (relativ molekylmassa) beräknas genom att summera atomernas massor och anges i enheter u (enhet för atomär massa). Den används för att räkna hur mycket av ett ämne som motsvarar ett visst antal molekyler via Avogadros tal.
Hur man studerar molekyler
Molekyler undersöks med många metoder:
- Spektroskopi (IR, NMR, UV‑vis) avslöjar bindningar och struktur.
- Kromatografi och masspektrometri separerar och identifierar molekyler.
- Röntgendiffraktion och kryo‑EM visar tredimensionella strukturer för fasta och biologiska molekyler.
- Kvantkemi och molekylmodellering beräknar energi, geometri och reaktivitet med hjälp av datorer.
Sammanfattning
Molekyler är byggstenarna i många ämnen och bestäms av vilka atomer som ingår och hur de binds ihop. Deras form, bindningstyper och polaritet styr materialegenskaper och kemiskt beteende. Från enkla diatomära gaser till jättemolekyler som proteiner — förståelsen av molekyler är central i kemi, biologi och materialvetenskap.
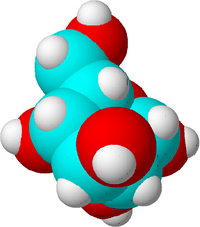
Detta är en sockermolekyl. Kolatomerna är blå, syreatomerna är röda och väteatomerna är vita för att visa skillnaden. I verkligheten har atomer ingen färg.
Bindning
För att en molekyl ska kunna existera måste atomerna hålla ihop. Detta sker när två atomer delar elektroner. I stället för att cirkulera runt en atom cirkulerar elektronen nu runt två. Detta kallas för en kovalent bindning. Ibland delas mer än en elektron. Ju fler elektroner som delas, desto starkare blir bindningen och desto starkare håller atomerna ihop.
Banden kan också brytas. Eftersom de flesta bindningar kräver energi för att bildas avger de också energi när de bryts. Men innan de flesta bindningar bryts måste molekylen värmas upp. Då börjar atomerna röra sig, och när de rör sig för mycket bryts bindningen. Molekyler som kräver mindre energi för att brytas än de avger när de bryts kallas bränslen. Ett stearinljus sitter till exempel bara där utan att något händer. Men när du tänder det med en tändsticka brinner det länge. Tändstickan tillför energi för att bryta de första bindningarna, som frigör tillräckligt med energi för att bryta bindningarna under dem, tills ljuset har brunnit ner.
Det finns också joniska bindningar.
Frågor och svar
F: Vad är en molekyl?
S: En molekyl är den minsta möjliga mängden av ett kemiskt ämne. Den består av atomer som är bundna till varandra i en viss form.
F: Hur många bindningar har syre-, kol- och kväveatomer?
Svar: Syreatomer har alltid två bindningar med andra atomer, kolatomer har alltid fyra bindningar med andra atomer och kväveatomer har alltid tre bindningar med andra atomer.
F: Vad säger den kinetiska teorin om gaser om molekyler?
Svar: Enligt den kinetiska teorin för gaser används ofta termen molekyl för alla gaspartiklar, oavsett deras sammansättning. Detta innebär att ädelgasatomer betraktas som molekyler eftersom de faktiskt är monatomära molekyler.
F: Hur beter sig molekyler i olika tillstånd?
S: I gaser som luft flyger molekylerna bara runt. I vätskor som vatten sitter molekylerna ihop men kan ändå röra sig. I fasta ämnen som socker kan molekylerna bara vibrera. I plasma (materiens fjärde tillstånd) är atomerna joniserade och kan inte bilda molekyler.
F: Vad är molekylformeln?
S: Molekylformeln används för att ange antalet atomer i en molekyl. C6H12O6 betyder till exempel en molekyl glukos, som består av sex kolatomer, tolv väteatomer och sex syreatomer.
Sök