Isolobalprincipen: definition, Hoffmann och tillämpningar i metallorganisk kemi
Isolobalprincipen: Hoffmanns modell för att förklara och förutse bindningar i metallorganisk kemi — teori, exempel och praktiska tillämpningar.
Isolobalprincipen (även känd som isolobalanalogi) är ett sätt att förutsäga bindningsegenskaperna hos metallorganiska föreningar. Inom metallorganisk kemi avser den strukturen hos organiska ligander som kan binda till oorganiska molekylfragment. Roald Hoffmann beskrev molekylfragment som isolobala "om antalet, symmetriegenskaperna, den ungefärliga energin och formen hos gränsorbitalerna och antalet elektroner i dem är liknande - inte identiska, men liknande". Man kan förutsäga bindningen och reaktiviteten hos en mindre känd bit från den hos en mer känd bit om de två molekylfragmenten har liknande frontier orbitaler, den högst ockuperade molekylorbitalen (HOMO) och den lägst oockuperade molekylorbitalen (LUMO). Isolobala föreningar är analoger till isoelektroniska föreningar som har samma antal valenceelektroner och samma struktur. En grafisk framställning av isolobala strukturer, där de isolobala paren är förbundna genom en dubbelpil med en halv orbital under, finns i figur 1.
För sitt arbete med den isolobala analogin tilldelades Hoffmann 1981 Nobelpriset i kemi, som han delade med Kenichi Fukui. I sin Nobelprisföreläsning betonade Hoffmann att den isolobala analogin är en användbar men enkel modell. Den misslyckas dock i vissa fall.
Vad innebär isolobalitet i praktiken?
I praktiken innebär isolobalprincipen att man kan ersätta ett atom- eller molekylfragment med ett annat fragment som har:
- samma antal frontier-orbitaler (d.v.s. orbitals som deltar i bindning eller reaktion),
- samma antal elektroner i dessa orbitaler,
- liknande symmetri och ungefär samma form och energi hos dessa orbitaler.
Om dessa villkor uppfylls kan fragmenten ofta bygga liknande bindningsmönster och ge upphov till strukturellt och reaktivt likartade föreningar. Detta gör det möjligt att överföra intuitiv och empirisk kunskap från välkända organiska fragment till mindre välkända metallfragment — eller tvärtom.
Hur identifierar man isolobala fragment?
En vanlig arbetsgång är:
- Gör ett elektronräknande för fragmentet (räkna valenselektroner och ta hänsyn till laddning och spinntilstånd).
- Studera MO-diagrammet eller beräkna de frontier-orbitaler som finns med hjälp av molekylorbitalteori eller ab initio/DFT-beräkningar.
- Jämför antal och symmetri för de relevanta orbitalerna samt deras relativa energier och nodstrukturer.
- Bedöm om steriska och elektroniska faktorer (t.ex. ligandfält, spinotillstånd) kan förändra jämförelsen.
Beräkningskemi är ofta nödvändigt för noggrann analys; isolobalitet är i grunden ett MO-baserat begrepp och därför lämpar sig metoder som DFT väl för att kontrollera likheter i orbitalformer och energier.
Exempel och tillämpningar i metallorganisk kemi
Isolobalprincipen används i flera viktiga sammanhang:
- Design av nya komplex: Man kan konstruera metallo-organiska analoger till kända organiska strukturer genom att ersätta kol- eller vätefragment med metalldelar som är isolobala.
- Förutsägelse av bindningsmönster: Om ett metallfragment är isolobalt med en kolradikal eller ett karbenfragment kan man förvänta sig att det binder på liknande sätt i en sammanlänkad struktur.
- Förståelse av kluster och metall-baserade nätverk: Isolobalitet hjälper till att relatera metallkluster till boraner och andra icke-metalliska kluster (liknande idéer som i Wade–Mingos-reglerna används ofta i samband med isolobalitetskonceptet).
- Katalys och reaktivitet: Genom att jämföra frontier-orbitaler kan man förutsäga möjliga reaktionsvägar eller aktiva metallcentra genom analogier till kända organiska reaktioner.
Som konkret, men förenklat, exempel används ofta isolobal analogi för att relatera enkla organiska fragment (t.ex. CH3·, CH2:, H·) till metallfragment som har motsvarande antal och typ av frontier-orbitaler. Detta kan ge vägledning vid syntes av icke-triviala metallkomplex eller vid tolkning av spektroskopiska data.
Begränsningar och kritik
Trots sin användbarhet har isolobalprincipen flera begränsningar:
- Approximation: Principen bygger på likheter i orbitalform och energi men dessa är sällan perfekta; små skillnader kan ge stora effekter i stabilitet eller reaktivitet.
- Elektronkorrelation och spinttillstånd: Metallfragment kan ha olika multipliciteter eller stark korrelation som inte motsvaras av enkla organiska fragment.
- Ligandfält och omgivning: Energiskillnader som orsakas av ligandfält, steriska påfrestningar eller lösningsmedel kan förvränga den isolobala likheten.
- Symmetri- och matchningsproblem: Om symmetrin hos orbitalerna inte matchar i en konkret bindningssituation kan förväntade analogier brytas.
Därför används isolobalitet ofta som ett heuristiskt verktyg — ett första steg eller en vägledande idé — och måste följas upp med kvantitativa beräkningar och experimentell verifiering.
Sammanfattning
Isolobalprincipen är ett kraftfullt koncept som kopplar samman organisk och metallorganisk kemi genom jämförelser av frontier-orbitaler. Den ger kemister möjlighet att överföra kunskap mellan olika typer av fragment och att förutsäga strukturer och reaktivitet. Samtidigt är det viktigt att känna till principens begränsningar och komplettera den med data från molekylorbitalberäkningar och experiment.
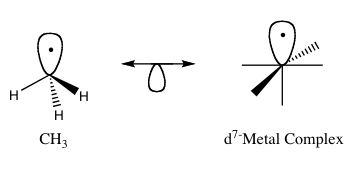
Figur 1: Grundläggande exempel på den isolobala analogin.
Frågor och svar
F: Vad är den isolobala principen?
S: Den isolobala principen (även känd som isolobal analogi) är ett sätt att förutsäga bindningsegenskaperna hos metallorganiska föreningar. Den relaterar strukturen hos organiska ligander som kan binda till oorganiska molekylfragment genom att jämföra deras högsta ockuperade molekylära orbital (HOMO) och lägsta oockuperade molekylära orbital (LUMO).
F: Vem föreslog den isolobala principen?
S: Roald Hoffmann föreslog den isolobala principen.
F: Hur förhåller sig den till isoelektroniska föreningar?
S: Isolobala föreningar är analoger till isoelektroniska föreningar som har samma antal valenceelektroner och samma struktur.
F: Vad fick Hoffmann för sitt arbete med detta koncept?
S: För sitt arbete med den isolobala analogin tilldelades Hoffmann 1981 Nobelpriset i kemi, som han delade med Kenichi Fukui.
F: Hur beskrev Hoffmann molekylära fragment?
S: Hoffmann beskrev molekylfragment som isolobala "om antalet, symmetriegenskaperna, den ungefärliga energin och formen hos gränsorbitalerna och antalet elektroner i dem är liknande - inte identiska, men liknande".
F: Hur använder man denna modell för att förutsäga bindning och reaktivitet?
S: Man kan förutsäga bindning och reaktivitet hos mindre kända delar utifrån bättre kända delar om de har liknande gränsorbitaler.
Fråga: Fungerar denna modell alltid korrekt?
S: Nej, den misslyckas i vissa fall.
Sök