Nitrit (NO2−): definition, egenskaper och användningsområden
Upptäck Nitrit (NO2−): definition, egenskaper och användningsområden — kemiska fakta, säkerhet och praktiska tillämpningar för industrin och laboratoriet.
Nitrit är en jon. Dess kemiska formel är NO2– . Den innehåller kväve i oxidationsklass +3. Nitriter är normalt sett starka oxidationsmedel. De flesta av dem är färglösa kristallina föreningar. Natriumnitrit är en vanlig nitrit. De är också svaga reduktionsmedel och oxideras till nitrater (NO3– ).
Definition och struktur
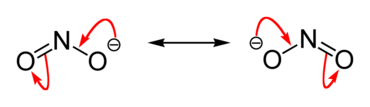
Nitritjonen NO2– består av ett kväve- och två syreatomer. Jonen har två resonansstrukturer där negativa laddningen är delokaliserad över syreatomerna, vilket ger två N–O-bindningar med delvis dubbelbindningskaraktär. Geometrin runt kvävet är vinklad (böjd), liknande lutningen i koldioxidderivat med en fri elektronparslutning på kvävet.
Framställning
Nitriter kan bildas på flera sätt:
- Partiell reduktion av nitrater (NO3–) i industrin eller i naturen.
- Genom behandling av kväveoxider (t.ex. NO och NO2) med alkalier.
- I laboratorium bildas nitrit genom behandling av nitrosylföreningar eller genom att lösa in kväveoxider i alkalisk vätska.
- I biologiska och jordkemiska processer uppträder nitrit som en mellanprodukt i nitrifikation och denitrifikation i kvävets kretslopp.
Kemiska egenskaper och reaktioner
- Under sura förhållanden bildas salpetersyra(II) (salpetersyra på engelska nitrous acid), HNO2, enligt jämvikten NO2– + H+ ⇌ HNO2. pKa för HNO2 är cirka 3,3, vilket betyder att HNO2 är instabilt och lätt sönderfaller.
- Nitrit kan fungera både som oxidationsmedel (t.ex. oxidera vissa metaller eller organiska föreningar) och som reduktionsmedel (reduceras till NO, N2O eller N2 beroende på villkor).
- Ett typiskt och viktigt reaktionsområde är diazotisering: primära aromatiska aminers behandling med HNO2 ger diazoniumjoner (Ar–N2+), ett centralt steg i syntes av färgämnen och andra organiska föreningar.
- Nitrit reagerar med sekundära aminer och karboxylsyror, och kan bilda nitrosaminer under vissa förhållanden — dessa är ofta hälsovådliga.
Fysikaliska egenskaper
- Många nitritsalt, såsom natriumnitrit, är vattenlösliga och förekommer som vita eller färglösa kristallina fasta ämnen.
- Löslighet och smältpunkt varierar med katjonen (t.ex. natrium-, kalium- eller bariumföreningar).
Användningsområden
- Livsmedelskonservering: Nitritsalt (främst natriumnitrit) används i charkprodukter för att hämma bakterietillväxt (särskilt Clostridium botulinum) och för att bevara färg och smak. Detta regleras noggrant eftersom nitrit kan bilda nitrosaminer.
- Organisk syntes: Används vid diazotisering och som nitrosationsmedel för att införa nitroso-grupper i organiska molekyler.
- Industriella tillämpningar: Korrosionsinhibitorer, färg- och pigmenttillverkning, samt som mellanprodukt i kemisk produktion.
- Analytisk kemi: Nitrit används i vissa färgreaktioner och tester för detektion av ämnen (se Griess-reaktion nedan).
- Medicinsk användning: I kontrollerade former kan nitriter användas i vissa läkemedel eller som kemoterapeutiska reagenser; historiskt har nitrit också använts vid behandling av cyanidförgiftning i kombination med andra medel.
Miljö och biogeokemi
Nitrit är en viktig mellanprodukt i kvävets kretslopp. I jord och vatten bildas nitrit vid ammoniumoxidation (nitrifikation) och vid reduktion av nitrat (denitrifikation). Nitrit i vattenmiljö kan vara giftigt för akvatiska organismer vid förhöjda halter och kan vidare omvandlas till nitrat eller kvävgas.
Hälsa och säkerhet
- Nitrit är toxisk vid intag och kan i blodet omvandla hemoglobin till methemoglobin, vilket försämrar syretransporten (methemoglobinémi). Särskilt känsliga är spädbarn.
- Reaktion mellan nitrit och sekundära aminer kan ge nitrosaminer, som är potentiellt cancerframkallande. Därför finns gränsvärden och noggrann reglering av nitritanvändning i livsmedel.
- Vid hantering i laboratorier och industri krävs lämpliga skyddsåtgärder: skyddshandskar, andningsskydd vid damm eller ångor, och förvaring åtskilt från syror och reducera ämnen för att undvika farliga reaktioner.
Analys och bestämning
En vanlig metod för nitritbestämning är Griess-reaktionen, där nitrit reagerar med sulfanilsyra och N-(1-naftyl)etylendiamin (NED) under sura betingelser och bildar ett färgat azo-färgämne som kan kvantifieras spektrofotometriskt. Andra metoder inkluderar jonkromatografi och elektroanalytiska tekniker.
Skillnad mot organiska nitriter
Observera att termen "nitrit" också kan syfta på organiska nitriter (struktur R–O–N=O, t.ex. isoamyl nitrit). Dessa är kemiskt skilda från den oorganiska nitritjonen NO2– och har andra egenskaper och användningsområden (t.ex. som vasodilatorer eller lösningsmedel i vissa sammanhang).
Sammanfattningsvis är nitritjonen NO2– en kemiskt mångsidig och industriellt viktig jon med både nyttiga användningar och potentiella hälsorisker. Kännedom om dess reaktioner, miljöroll och säkerhet är avgörande för korrekt hantering och reglering.
Nitrit
Relaterade sidor
- Nitrat
- Nitrid
- Azid
Sök