Väteisotoper: Protium, deuterium & tritium – egenskaper och fakta
Lär dig allt om väteisotoper: protium, deuterium och tritium — deras egenskaper, stabilitet, radioaktivitet och viktiga fakta på ett tydligt och lättillgängligt sätt.
Väte har tre huvudsakliga isotoper: protium (1H), deuterium (2H) och tritium (3H). Dessa isotoper bildas naturligt i naturen. Protium och deuterium är stabila. Tritium är radioaktivt och har en halveringstid på cirka 12 år. Forskare har skapat fyra andra väteisotoper (4H till7 H), men dessa isotoper är mycket instabila och förekommer inte naturligt.
De viktigaste isotoperna av väte är unika eftersom de är de enda isotoperna som har ett namn. Dessa namn används fortfarande idag. Deuterium och tritium får ibland egna symboler, D och T. Internationella unionen för ren och tillämpad kemi gillar dock inte dessa namn särskilt mycket, även om de ofta används. Det finns andra isotoper som hade egna namn när forskarna studerade radioaktivitet. Men deras namn används inte längre i dag.
Egenskaper och nukleära skillnader
Protium (1H) består av en ensam proton i kärnan och saknar neutroner. Det är den vanligaste formen av väte och står för ungefär 99,985 % av naturligt väte.
Deuterium (2H eller D) har en proton och en neutron i kärnan. Deuterium är stabilt och förekommer i jordens vatten i mycket små mängder — ungefär 0,015–0,02 % av väteatomerna (cirka 150–200 delar per miljon). Den extra neutronen gör att deuteriumatomens massa är ungefär dubbelt så stor som protiums, vilket ger märkbara isotopa effekter i kemiska och fysikaliska egenskaper.
Tritium (3H eller T) har en proton och två neutroner. Det är radioaktivt och sönderfaller via betastrålning med en halveringstid på cirka 12,32 år. Tritium förekommer i spårmängder naturligt (framför allt som följd av kosmisk strålning i atmosfären) men ökas också genom mänskliga aktiviteter som kärnreaktorer och tidigare kärnvapenprov.
Kemiska och fysikaliska konsekvenser
Skillnader i kärnmasseantal leder till isotopa effekter: bindningsstyrkor, vibrationsfrekvenser och reaktionshastigheter skiljer sig mellan H, D och T. Exempelvis är bindningarna till deuterium något starkare och vibrerar med lägre frekvens än motsvarande vätebindningar. Detta ger lägre reaktionshastigheter för många processer (den så kallade kinetiska isotop-effekten).
Ett synligt exempel är tungt vatten (D2O), där väteatomerna i vatten är ersatta med deuterium. Tungt vatten har något högre densitet, högre kokpunkt och andra avvikande fysikaliska egenskaper jämfört med vanligt vatten (H2O). I mycket höga andelar kan tungt vatten störa biologiska processer och vara toxisk för levande organismer.
Naturlig förekomst och tillverkning
Protium och deuterium finns i naturen i vattenmolekyler och i organiskt material. Deuterium separeras industriellt från vanligt vatten genom metoder som destillation, utbytesprocesser och elektrolys för att producera deutererade föreningar och tungt vatten.
Tritium bildas naturligt i atmosfären genom kosmisk strålning (neutroninducerade processer) och kan också bildas i reaktorer, t.ex. genom neutronbestrålning av litium eller som biprodukt i reaktorbränslen och tunga-vatten-reaktorer. Tritium kan också uppstå vid kärnvapenprovsprängningar, vilket historiskt ökade halterna i atmosfären.
Användningsområden
- Deuterium: används i vetenskaplig forskning (deutererade lösningsmedel för NMR-spektroskopi), som tracer i miljö- och biokemiska studier, i tungt vatten som moderator i vissa kärnreaktorer (t.ex. CANDU), och i syntes av tyngre isotopvarianter av kemiska föreningar.
- Tritium: används som radioaktiv källa i självlysande märken och nödbelysning (genom betastrålning som exciterar fosfor), inom forskningen och som bränsle för fusionsforskning (D–T-fusion ger höga energier). På grund av sin radioaktivitet regleras hanteringen noggrant.
- Protium: vanligaste väteformen och basen för alla vanliga kemiska och biologiska processer.
Säkerhet och miljö
Tritium är en lågenergetisk betastrålare och utgör en relativt liten extern strålningsrisk, men är en intern risk om det inhaleras eller intas eftersom det kan införlivas i kroppsvatten och organiska molekyler. Därför krävs särskild kontroll och avfallshantering vid anläggningar som producerar eller använder tritium.
Tungt vatten i mycket höga koncentrationer kan påverka biologiska processer genom isotopisk utspädning av normala vätevägar. Normal exponering för deuterium i miljön utgör dock ingen farlig risk eftersom koncentrationerna är mycket låga.
Övriga isotoper (4H–7H)
Forskarna har framställt isotoperna 4H till 7H i partikelacceleratorer och andra experimentella anordningar. Dessa kärnor är extremt instabila och sönderfaller mycket snabbt (oftast i loppet av bråkdelar av en sekund), så de förekommer inte naturligt och har inga praktiska tillämpningar utanför kärnfysikforskning.
Sammanfattning
De tre huvudisotoperna av väte — 1H (protium), 2H (deuterium) och 3H (tritium) — skiljer sig i antal neutroner, massa och därmed i vissa kemiska och fysikaliska egenskaper. De har viktiga tillämpningar inom forskning, energi och industri, men särskilt tritium kräver försiktig hantering på grund av sin radioaktivitet. Internationella rekommendationer (t.ex. från IUPAC) föredrar formella beteckningar som 2H och 3H, även om D och T ofta används i praxis.
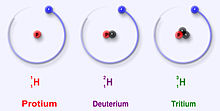
De tre stabilaste isotoperna av väte
Protium (väte-1)
Protium är den vanligaste isotopen av väte. Den utgör mer än 99,98 % av allt väte i universum. Den kallas protium eftersom dess kärna endast har en proton. Protium har en atommassa på 1,00782504(7) u. Symbolen för protium är 1H.Protiums proton har aldrig sönderfallit i en observation, så forskarna tror att protium är en stabil isotop. Nya teorier inom partikelfysiken förutsäger att en proton kan sönderfalla, men att detta sönderfall är mycket långsamt. Protonerna sägs ha en halveringstid på 1036 år. Om protonens sönderfall är sant är alla andra kärnor som sägs vara stabila i själva verket bara observationsmässigt stabila, dvs. de ser ut att vara stabila. Nya experiment har visat att om protonernas sönderfall verkligen förekommer skulle det ha en halveringstid på 6,6 × 1033 år.
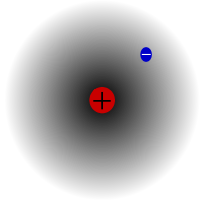
Protium, den vanligaste isotopen av väte. Den är speciell eftersom den är den enda isotop som saknar neutroner.
Deuterium (väte-2)
Deuterium, eller 2H eller ibland D, är en annan stabil isotop av väte. Isotopen har en proton och en neutron. Den utgör ungefär 0,0026-0,0184 % av alla väteatomer på jorden. Deuterium är mindre i vätgas på jorden och mer i havsvatten (0,015 % eller 150 ppm). Deuterium är inte radioaktivt och skadar inte levande organismer. Deuterium kan också bilda vattenmolekyler. Vatten som innehåller deuterium i stället för protium kallas tungt vatten.
Tritium (väte-3)
Tritium (3H) är den mest stabila radioisotopen av väte. Av alla radioaktiva väteisotoper är tritium den minst radioaktiva. Den har en proton och två neutroner i sin kärna. Tritium sönderfaller genom beta-minus-sönderfall och övergår till helium-3. Den har en halveringstid på 12,32 år.Tritium bildas naturligt genom samverkan mellan gaserna i den övre atmosfären och kosmisk strålning. Det bildas också vid kärnvapentester. Tritium och deuterium används vid D-T-kärnfusion i stjärnor för att avge mycket energi.
Frågor och svar
F: Hur många huvudisotoper av väte finns det?
S: Det finns tre huvudsakliga isotoper av väte: protium, deuterium och tritium.
F: Är protium och deuterium stabila isotoper?
S: Ja, protium och deuterium är stabila isotoper.
F: Vad är halveringstiden för tritium?
S: Tritium är radioaktivt och har en halveringstid på ca 12 år.
F: Hur många andra väteisotoper har forskare skapat?
S: Forskarna har skapat fyra andra väteisotoper: 4H till 7H.
F: Finns dessa fyra ytterligare väteisotoper naturligt?
S: Nej, dessa isotoper är mycket instabila och finns inte naturligt.
F: Vad gör de viktigaste väteisotoperna unika?
S: Huvudisotoperna av väte är unika eftersom de är de enda isotoperna som har ett namn.
F: Har deuterium och tritium sina egna symboler?
S: Ja, deuterium och tritium får ibland sina egna symboler: D och T. International Union of Pure and Applied Chemistry gillar dock inte dessa namn särskilt mycket, även om de ofta används.
Sök