Isotoper – definition, exempel, masstal och radioaktivitet
Lär dig om isotoper: definition, masstal, exempel och radioaktivitet. Förstå skillnaden mellan stabila och radioaktiva isotoper enkelt och tydligt.
Atomerna i ett kemiskt grundämne kan finnas i flera varianter som har mycket liknande kemiskt beteende men olika massa. Dessa varianter kallas isotoper av grundämnet. Atomer av samma grundämne har alltid samma antal protoner, men olika isotoper skiljer sig åt i antal neutroner. Eftersom neutroner bidrar till atomkärnans massa har isotoper olika massa. Massa är ett mått på hur mycket substans (eller materia) något innehåller, och föremål med olika massa har också ofta olika vikt i ett gravitationsfält.
Masstal och notering
Atomer av samma grundämne har samma antal protoner, vilket kallas atomnummer (vanligt betecknat Z). Olika isotoper hos ett grundämne har olika antal neutroner, och därför olika masstal (vanligt betecknat A). Masstalet är summan av antalet protoner och neutroner i kärnan: A = Z + N (där N är antalet neutroner).
En isotop betecknas ofta genom att ange grundämnet och masstalet. Till exempel är symbolen för kol C och alla kolatomer har 6 protoner. Den vanligaste isotopen av kol har också 6 neutroner, vilket ger ett masstal på 12, och den skrivs kol-12 eller 12 C. Den isotop av kol som har 8 neutroner skrivs kol-14 eller 14 C. Ett annat vanligt sätt att skriva nuklidsymbolen är AZX, där X är grundämnets kemiska symbol, A masstalet och Z atomnumret.
Stabila och radioaktiva isotoper
Vissa isotoper är stabila och förändras inte spontant över tid. Andra är instabila och sönderfaller till en annan nuklid genom radioaktivt sönderfall. Sådana instabila varianter kallas radioaktiva isotoper eller radionuklider, medan de som inte sönderfaller kallas stabila isotoper.
Radioaktivt sönderfall kan ske på flera sätt, bland annat alfa‑sönderfall (sändning av en heliumkärna), beta‑sönderfall (omvandling mellan proton och neutron med utsändning av en elektron eller positron) och utsändning av högenergetisk gamma‑strålning. Varje radioaktiv isotop har en typisk halveringstid — den tid det tar för hälften av en given mängd att sönderfalla — som kan vara allt från bråkdelar av en sekund till miljarder år.
Exempel: kol-14 är en radioaktiv isotop som används för radiokolmetoden (åldersbestämning av organiskt material). Ett annat exempel är väte‑isotoperna protium (1H), deuterium (2H) och tritium (3H) — där tritium är radioaktivt med relativt kort halveringstid.
Användning och betydelse
Isotoper är viktiga i många områden:
- Geologi och arkeologi: Åldersbestämning med radioaktiva isotoper (t.ex. kol‑14, uran‑bly).
- Medicinsk diagnostik och behandling: Radioaktiva spårämnen (t.ex. i PET‑skanning) och terapeutiska isotoper för cancerbehandling.
- Industri: Spårning av läckor, materialprovning och strålkällor för sterilisering.
- Forskning: Studier av kemiska reaktioner och biologiska processer med stabila eller märkta isotoper.
- Energiproduktion: Bestämda isotoper av t.ex. uran och plutonium används i kärnreaktorer och kärnvapen.
I naturen förekommer ofta flera isotoper av ett grundämne i bestämda relativa mängder (isotopisk naturlig abundans). Den relativa atomvikten som anges i det periodiska systemet är vanligen ett viktat medel av massorna för de naturliga isotoperna, viktat med deras relativa abundans.
Relaterade begrepp
Några närliggande begrepp att känna till:
- Nuclid eller nuklid: en art med ett bestämt antal protoner och neutroner (alltså en bestämd isotop av ett grundämne).
- Isobarer: nuklider med samma masstal A men olika atomnummer Z (olika grundämnen med samma totalantal nukleoner).
- Isotoner: nuklider med samma antal neutroner N men olika antal protoner.
- Isotopseffekt: massdifferenser mellan isotoper kan ge små men mätbara skillnader i kemiska reaktioner och fysiska egenskaper, vilket utnyttjas i forskning och tekniska tillämpningar.
Sammanfattningsvis är isotoper olika versioner av samma grundämne som skiljer sig i neutronantal och därmed i massa. Vissa är stabila, andra radioaktiva, och deras egenskaper gör dem användbara inom vetenskap, medicin, industri och energiproduktion. Ordet "isotop", som betyder "på samma plats", kommer från det faktum att isotoper av samma grundämne befinner sig på samma plats i det periodiska systemet.
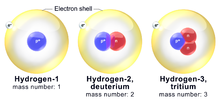
Isotoper av väte
Kemiska egenskaper
I en neutral atom är antalet elektroner lika stort som antalet protoner. Därför har isotoper av samma grundämne också samma antal elektroner och samma elektroniska struktur. Hur en atom agerar bestäms av dess elektroniska struktur, så isotoper av samma grundämne har nästan samma kemiska beteende, t.ex. vilka molekyler de kan bilda. Det är mycket svårt att skilja isotoperna av ett grundämne från en blandning av olika isotoper på grund av hur likartat detta beteende är.
Tyngre isotoper reagerar kemiskt långsammare än lättare isotoper av samma grundämne. Denna "masseffekt" är stor för protium (1 H) och deuterium (2 H), eftersom deuterium har dubbelt så stor massa som protium. För tyngre grundämnen är det relativa atomviktsförhållandet mellan isotoperna mycket mindre, så masseffekten är vanligtvis liten.
Stabilitet
Vissa isotoper är inte stabila och övergår därför till en annan isotop eller ett annat grundämne genom radioaktivt sönderfall. Dessa kallas instabila isotoper eller radioaktiva isotoper. Den genomsnittliga tid det tar för en isotop att sönderfalla kallas halveringstid. Andra isotoper sönderfaller inte och är därför inte radioaktiva. De kallas stabila isotoper.
Varje atom har en atomkärna som består av protoner och neutroner som hålls samman av kärnkraften. Eftersom protoner har positiv elektrisk laddning stöter de bort varandra. Neutronerna är neutrala och de stabiliserar kärnan. Neutronerna håller protonerna något isär. Detta minskar den elektrostatiska avstötningen mellan protonerna, så att kärnkraften kan hålla ihop protonerna och neutronerna. En eller flera neutroner är nödvändiga för att två eller flera protoner ska kunna bindas till en kärna. När antalet protoner ökar, ökar också antalet neutroner som behövs för att få en stabil kärna.
Vissa grundämnen har bara en enda isotop som är stabil. Fluor-19 (19 F) är till exempel den enda stabila isotopen av fluor. De andra isotoperna av fluor sönderfaller snabbt, så de förekommer inte i naturen. Andra grundämnen har många stabila isotoper. Xenon har till exempel sju stabila isotoper. Det har också två isotoper som sönderfaller mycket långsamt och som finns i naturen. Det största antalet stabila isotoper för ett grundämne är tio, för grundämnet tenn. Vissa grundämnen har inga stabila isotoper, till exempel curium. Dessa finns bara på jorden eftersom de skapas i kärnreaktorer, kärnexplosioner eller partikelacceleratorer.
Vissa instabila isotoper förekommer naturligt på jorden eftersom de har en mycket lång halveringstid. Till exempel har uran-238 en halveringstid på 4468 miljoner år. Halveringstiden för radium-226 är endast 1600 år, och den finns i naturen eftersom den ständigt bildas genom sönderfall av uran-238.
Väte har tre vanliga isotoper. Den vanligaste isotopen av väte kallas protium (1 H), som har en proton och inga neutroner. En väteatom som har en proton och en neutron (atommassa 2) kallas deuterium (2 H). Väteatom med en proton och två neutroner (atommassa 3) kallas tritium (3 H). Protium och deuterium är stabila isotoper, medan tritium är en radioaktiv isotop.
De tyngsta grundämnena i det periodiska systemet är alla radioaktiva. Alla isotoper av radon, torium och uran är radioaktiva eftersom de är mycket tunga. Detta beror på att kärnkrafterna inne i atomens kärna inte kan hålla ihop alla protoner och neutroner.
Relaterade sidor
- Isotopelektrokemi
- Radionuklid
Frågor och svar
F: Vad är isotoper?
S: Isotoper är olika typer av atomer av ett kemiskt grundämne som har ett mycket likartat beteende men väger olika mycket.
F: Hur skiljer sig isotoper från varandra?
S: Atomer av samma grundämne har samma antal protoner, men olika isotoper har olika antal neutroner. Därför har de också olika masstal, vilket är antalet protoner plus antalet neutroner.
F: Är alla isotoper stabila?
S: Nej, vissa isotoper är inte stabila och övergår därför till en annan isotop eller ett annat grundämne genom radioaktivt sönderfall. Dessa kallas radioaktiva isotoper medan andra som inte är radioaktiva kallas stabila isotoper.
F: Hur kan en isotop identifieras?
S: En isotop namnges vanligtvis genom att man anger grundämnet och dess masstal. Kol-12 eller 12C är till exempel en atom med 6 protoner och 6 neutroner medan kol-14 eller 14C i stället har 8 neutroner.
F: Vad betyder "isotop"?
S: Ordet "isotop" betyder "på samma plats" och syftar på att alla atomer av samma grundämne förekommer på samma plats i det periodiska systemet.
F: Varför väger atomer med fler neutroner mer än atomer med färre neutroner?
Svar: Atomer med fler neutroner väger mer eftersom de innehåller ytterligare partiklar (neutroner) som ökar deras totala massa jämfört med atomer med färre neutroner.
Sök