Reaktionsmekanism – definition, steg och exempel i organisk kemi
Lär dig reaktionsmekanismer i organisk kemi — definition, steg, intermediärer, övergångstillstånd och praktiska exempel med pilskjutning för att förstå och styra reaktioner.
En reaktionsmekanism är en beskrivning steg för steg av hur en kemisk reaktion fungerar. Vanligtvis kan man bara se den totala förändringen i en reaktion. Det som görs däremellan reagerar för snabbt för att synas. Dessa kallas intermediärer, och när man går från en intermediär till en annan passerar man ett övergångstillstånd. Det är dock viktigt att förstå alla de steg som gör den totala förändringen. Detta eftersom man då kan förstå svårare reaktioner eller försöka få en reaktion att fungera på ett visst sätt.
Det finns många olika typer av reaktionsmekanismer. I organisk kemi är de vanligaste nukleofila substitutionen, eliminering och addition. Man använder ibland pilskjutning för att rita hur elektroner rör sig under en reaktion. Detta gör det lätt att se vilka bindningar som bildas och vilka som bryts under processen.
Grundläggande begrepp
- Intermediärer: Kortlivade arter (t.ex. radikaler, karbokatjoner, karbanjoner eller karbenes) som visas som lokala minima i en energiprofil.
- Övergångstillstånd (transition state): En högenergetisk konfiguration längs reaktionsvägen. Den kan inte isoleras men kan kännetecknas genom kinetiska och teoretiska metoder.
- Energi- och reaktionskoordinat: En energidiagram visar aktiveringsenergi (E‡), intermediärernas relativa stabilitet och om reaktionen är exoterm eller endoterm.
- Koncerted vs stegvis: I en concerted reaktion sker alla bindningsändringar i ett enda steg (inga isolerbara intermediärer). I en stegvis reaktion bildas intermediärer mellan stegen.
Vanliga mekanismklasser i organisk kemi
- Nukleofil substitution (SN1 och SN2):
- SN2: Ett bimolekylärt, concerted steg där nukleofilen attackerar samtidigt som lämnande grupp lämnar. Typiska kännetecken: bakifrån-attack, inversion av stereokemi (Walden-inversion) och hastighet som beror på både substrat och nukleofil (rate = k[Nu][R-LG]). Ett praktiskt exempel är CH3Br + OH- → CH3OH + Br- (SN2).
- SN1: Ett stegvis förlopp där först den lämnande gruppen avgår och bildar en karbokatjon (intermediär), därefter fångas karbokatjonen av nukleofilen. Kännetecken: racemisering vid stereocenter, hastighet som beror endast på substratet (rate = k[R-LG]). Ett klassiskt exempel är hydrolys av tert-butylklorid.
- Eliminering (E1 och E2):
- E2: Concerted borttagning av en proton samtidigt som en lämnande grupp avlägsnas, vilket ger en dubbelbindning. Hastigheten beror på både bas och substrat.
- E1: Först bildas en karbokatjon (som i SN1), sedan förloras proton för att ge en alkene. E1-profil liknar SN1 vad gäller intermediärbildning.
- Addition: Vanligt vid reaktioner mot dubbel- eller trippelbindningar (t.ex. addition av HBr till alken). Addition kan vara concerted eller ske via karbokation/karbanjonintermediärer beroende på reaktionsförhållanden.
Vad påverkar vilken mekanism som sker?
- Substratstruktur: Primära, sekundära och tertiära kol påverkar om SN1/SN2 eller E1/E2 är mest sannolikt.
- Lämnande grupp: En bra lämnande grupp (t.ex. halider, sulfonater) underlättar både substitution och eliminering.
- Nukleofil eller bas: Starkare nukleofiler gynnar SN2; starka baser gynnar eliminering (E2).
- Solvens: Protetiska lösningsmedel stabiliserar joner och kan gynna SN1/E1, aprotiska lösningsmedel kan öka reaktiviteten för nukleofiler i SN2.
- Temperatur och koncentration: Högre temperatur brukar gynna eliminering över substitution i många fall.
- Katalysatorer: Syror, baser eller metallkatalysatorer kan ändra vägen genom att stabilisera intermediärer eller sänka aktiveringsenergin.
Stereokemi och regiokontroll
Stereokemiska utfall (t.ex. retention eller inversion) och var i ett substrat en reaktion sker (regioselektivitet, t.ex. Markovnikov- vs anti-Markovnikov-addition) är ofta beroende av mekanismen. Exempelvis ger SN2-inversion medan SN1 kan ge blandade produkter på grund av karbokatjonens planära natur.
Hur man studerar reaktionsmekanismer experimentellt
- Kinetik: Bestämning av reaktionsordning och hastighetslag ger information om antalet arter i övergångstillståndet.
- Isotopmärkning och kinetiska isotopeffekter: Byter man t.ex. H mot D kan förändring i hastighet avslöja om en protonavgivning ingår i det hastighetsbestämmande steget.
- Spektroskopi: NMR, IR och masspektrometri kan ge ledtrådar till intermediärer eller produkters struktur.
- Fångst av intermediärer: Kemiska fällor kan användas för att fånga och identifiera kortlivade arter.
- Teoretiska metoder: Kvantkemi (DFT) används för att beräkna energiprofil, övergångstillstånd och förklara experimentella observationer.
Några användbara principer
- Hammonds postulat: Övergångstillstånd liknar närmast den närliggande stabila arten (reaktant eller produkt) i energiprofilen. Hjälper att förutsäga egenskaper hos övergångstillstånd.
- Begreppet termodynamik vs kinetik: En produkt kan vara termodynamiskt mest stabil men bildas långsammare om aktiveringsbarriären är hög. Reaktionsvillkor kan optimeras för att styra mot kinetiska eller termodynamiska produkter.
Sammanfattning
En reaktionsmekanism beskriver med detaljer hur en kemisk omvandling sker, vilka intermediärer som bildas, vilka bindningar som bryts och bildas, samt vilka faktorer som styr vägen. Genom att kombinera experimentella tekniker och teoretiska beräkningar kan kemister förstå och kontrollera reaktioner — vilket är centralt för syntes, katalysdesign och för att tolka biologiska reaktionsvägar.
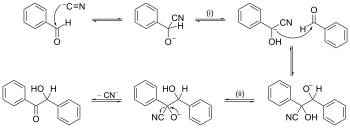
Ett exempel på en reaktionsmekanism med pilskjutning
Frågor och svar
F: Vad är en reaktionsmekanism?
S: En reaktionsmekanism är en steg-för-steg-förklaring av hur en kemisk reaktion fungerar.
F: Varför är det viktigt att förstå alla steg i en reaktionsmekanism?
S: Det är viktigt att förstå alla steg i en reaktionsmekanism för att förstå svåra reaktioner eller försöka få en reaktion att fungera på ett visst sätt.
F: Vad är mellanprodukter i en kemisk reaktion?
S: Intermediärer är de saker som bildas mellan reaktionerna och som reagerar för snabbt för att kunna ses i en kemisk reaktion.
F: Vad är ett övergångstillstånd i en kemisk reaktion?
S: Ett övergångstillstånd korsas när man går från en mellanprodukt till en annan under en kemisk reaktion.
F: Vilka är de vanligaste typerna av reaktionsmekanismer inom organisk kemi?
S: De vanligaste typerna av reaktionsmekanismer inom organisk kemi är nukleofil substitution, eliminering och addition.
F: Vad är pilskjutning i en kemisk reaktionsmekanism?
S: Piltryckning används ibland för att rita hur elektroner flyttar runt under en reaktion. Detta gör det enkelt att se vilka bindningar som bildas och vilka som bryts under processen.
F: Vilken information kan man få genom att förstå en reaktionsmekanism?
S: Att förstå en reaktionsmekanism kan ge information om hur man får en reaktion att fungera på det sätt man vill eller för att förstå svårare reaktioner.
Sök