Övergångstillstånd
I en kemisk reaktion är övergångstillståndet den punkt där energin är högst. Denna energi kallas aktiveringsenergi. När två eller flera molekyler blandas kommer de att träffa varandra. Om de träffas med tillräckligt mycket energi för att gå igenom övergångstillståndet kommer de att reagera och bilda nya molekyler. I övergångstillståndet bildas nya bindningar medan de gamla bryts. I ett diagram eller en ritning markeras övergångstillståndet ofta med symbolen ‡ med dubbel dolk.
Det är mycket svårt att studera ett övergångstillstånd. Detta beror på att den har så hög energi att molekylerna stannar i den formen under en mycket kort tid, vanligtvis femtosekunder. Det är viktigt att inte förväxla övergångstillstånd med intermediärer. Intermediärer finns vid minimala energipunkter och de kan leva under mycket lång tid. Liksom ett övergångstillstånd befinner sig dock en intermediär mellan reagens och produkter i en reaktion.
Att studera övergångstillstånd är mycket viktigt för att förstå reaktionsmekanismer. Det finns teorier och datorprogram som kan användas för att beräkna hur övergångstillståndet ser ut. Detta är en del av den kemiska kinetiken.
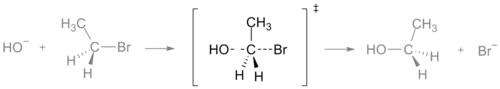
Övergångstillståndet i en SN2-reaktion
Frågor och svar
F: Vad är övergångstillståndet i en kemisk reaktion?
S: Övergångstillståndet är den punkt där det finns ett maximalt energivärde i en kemisk reaktion.
F: Vad är aktiveringsenergin i en kemisk reaktion?
S: Den energi som krävs för att en reaktion ska ske kallas aktiveringsenergi.
F: Vad händer när två eller flera molekyler blandas i en kemisk reaktion?
S: När två eller flera molekyler blandas kommer de att träffa varandra. Om de träffas med tillräcklig energi för att gå igenom övergångstillståndet kommer de att reagera och bilda nya molekyler.
F: Vad används symbolen dubbel dolk (‡) för i ett diagram eller en ritning av en kemisk reaktion?
S: Symbolen med dubbel dolk (‡) används för att markera övergångstillståndet i ett diagram eller en ritning av en kemisk reaktion.
F: Varför är det svårt att studera övergångstillståndet i en kemisk reaktion?
S: Det är mycket svårt att studera övergångstillståndet i en kemisk reaktion eftersom det har så hög energi att molekylerna stannar i den formen under en mycket kort tid, vanligtvis femtosekunder.
F: Vad är en intermediär i en kemisk reaktion?
S: En intermediär är en molekyl som finns vid de lägsta energipunkterna i en kemisk reaktion och som kan leva under mycket lång tid.
F: Varför är det viktigt att studera övergångstillstånd för att förstå reaktionsmekanismer?
S: Att studera övergångstillstånd är viktigt för att förstå reaktionsmekanismer eftersom det hjälper till att avgöra hur en reaktion uppstår och hur man kontrollerar eller manipulerar den.
Sök