Kemisk reaktion
En kemisk reaktion sker när en eller flera kemikalier omvandlas till en eller flera andra kemikalier. Exempel:
- järn och syre bildar tillsammans rost
- ättika och bakpulver bildar tillsammans natriumacetat, koldioxid och vatten
- saker som brinner eller exploderar
- många reaktioner som sker i levande organismer
- elektrokemiska reaktioner vid urladdning eller uppladdning av batterier
Vissa reaktioner är snabba och andra långsamma. Vissa reaktioner sker med olika hastighet, beroende på temperatur eller andra saker. Trä reagerar till exempel inte med luft när det är kallt, men om det blir tillräckligt varmt börjar det brinna. Vissa reaktioner avger energi. Dessa är exoterma reaktioner. Vid andra reaktioner tas energi upp. Dessa är endotermareaktioner.
Kärnreaktioner är inte kemiska reaktioner. Kemiska reaktioner involverar endast atomernas elektroner, medan kärnreaktioner involverar protoner och neutroner i atomkärnorna.

Rostande järn

En brasa är ett exempel på redox
Fyra grundläggande typer
Syntes
I en syntesreaktion kombineras två eller flera enkla ämnen för att bilda ett mer komplext ämne.
A + B ⟶ A B {\displaystyle A+B\longrightarrow AB}
"Två eller flera reaktanter ger en produkt" är ett annat sätt att identifiera en syntesreaktion. Ett exempel på en syntesreaktion är kombinationen av järn och svavel för att bilda järn(II)sulfid:
8 F e + S 8 ⟶ 8 F e S {\displaystyle 8Fe+S_{8}\longrightarrow 8FeS}
Ett annat exempel är enkel vätgas som kombineras med enkel syrgas för att producera ett mer komplext ämne, t.ex. vatten.
Nedbrytning
En nedbrytningsreaktion är när ett mer komplext ämne bryts ner i enklare delar. Den är alltså motsatsen till en syntesreaktion och kan skrivas som:
A B ⟶ A + B {\displaystyle AB\longrightarrow A+B}
Ett exempel på en nedbrytningsreaktion är elektrolys av vatten för att skapa syre och vätgas:
2 H 2 O ⟶ 2 H 2 + O 2 {\displaystyle 2H_{2}O\longrightarrow 2H_{2}+O_{2}}}
Enbart utbyte
I en enkel utbytesreaktion ersätter ett enda obundet element ett annat i en förening; med andra ord byter ett element plats med ett annat element i en förening Dessa reaktioner har den allmänna formen av:
A + B C ⟶ A C + B {\displaystyle A+BC\longrightarrow AC+B}
Ett exempel på en enkel förskjutningsreaktion är när magnesium ersätter väte i vatten för att skapa magnesiumhydroxid och vätegas:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\displaystyle Mg+2H_{2}O\longrightarrow Mg(OH)_{2}+H_{2}}
Dubbel ersättning
I en dubbel utbytesreaktion byter anjoner och katjoner i två föreningar plats och bildar två helt olika föreningar. Dessa reaktioner har den allmänna formen:
A B + C D ⟶ A D + C B {\displaystyle AB+CD\longrightarrow AD+CB}
När till exempel bariumklorid (BaCl2 ) och magnesiumsulfat (MgSO4 ) reagerar 42−byter SO-anjonen plats med 2Cl-anjonen−, vilket ger föreningarna BaSO4och MgCl . 2
Ett annat exempel på en dubbelförskjutningsreaktion är reaktionen av bly(II)nitrat med kaliumjodid för att bilda bly(II)jodid och kaliumnitrat:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\displaystyle Pb(NO_{3})_{2}+2KI\longrightarrow PbI_{2}+2KNO_{3}}
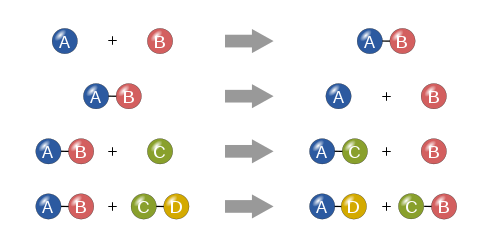
De fyra grundläggande kemiska reaktionstyperna: syntes, nedbrytning, enkel ersättning och dubbel ersättning.
Ekvationer
En kemisk reaktion visas med en ekvation:
A + B ⟶ C + D {\displaystyle \mathrm {A+B\longrightarrow C+D} }
Här reagerar A och B med C och D i en kemisk reaktion.
Detta är ett exempel på en förbränningsreaktion.
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
Relaterade sidor
- Organisk reaktion
- Redox
Frågor och svar
F: Vad är en kemisk reaktion?
S: En kemisk reaktion sker när en eller flera kemikalier förändras till en eller flera andra kemikalier.
F: Kan du ge exempel på kemiska reaktioner?
S: Ja, några exempel på kemiska reaktioner är att järn och syre kombineras för att bilda rost, att vinäger och bakpulver kombineras för att bilda natriumacetat, koldioxid och vatten, att saker brinner eller exploderar och många reaktioner som sker inuti levande varelser, t.ex. fotosyntesen.
F: Är alla kemiska reaktioner snabba?
S: Nej, vissa reaktioner är snabba och andra är långsamma. Vissa sker med olika hastighet beroende på temperatur eller andra saker.
F: Vad är en exotermisk reaktion?
S: En exotermisk reaktion är en reaktion som avger energi.
F: Vad är en endotermisk reaktion?
S: En endotermisk reaktion är en reaktion som tar upp energi.
F: Är kärnreaktioner kemiska reaktioner?
S: Nej, kärnreaktioner är inte kemiska reaktioner. Kemiska reaktioner involverar endast atomernas elektroner; kärnreaktioner involverar protonerna och neutronerna i atomkärnorna.
F: Kan temperaturen påverka hastigheten på en kemisk reaktion?
S: Ja, beroende på temperaturen eller andra saker kan vissa reaktioner ske med olika hastighet. Trä reagerar till exempel inte med luft när det är kallt, men om det blir tillräckligt varmt börjar det brinna.
Sök









