Tioketon (thion) – definition, struktur, reaktivitet och egenskaper
Tioketon (thion): definition, struktur, reaktivitet och egenskaper — lär dig om R2C=S, svavlets effekt på reaktivitet, instabilitet, cycloadditioner och jämförelse med thialer.
Tioketon (eller thion) är en organisk funktionell grupp med allmän form R2C=S. Den kan ses som en vanlig keton där syreatomen är utbytt mot en svavelatom: svavel bildar en dubbelbindning till kolet och bär två ensammande par. Den enkla strukturbeskrivningen R2C=S återges ofta i samband med grundläggande molekyl- och gruppbeskrivningar.
Struktur och bindning
C=S-bindningen skiljer sig från C=O på flera sätt. Sulfurs 3p-orbitaler ger sämre överlapp med kolets 2p-orbitaler än syrets 2p-orbitaler, vilket leder till en längre och något svagare π-bindning än i en karbonyl. Bindningen är mer polariserad och svavel är mer polariserbart än syre. Konsekvenserna blir bland annat:
- lägre energiskt liggande π*‑orbital (ger ofta starka n→π* och π→π* övergångar och därmed intensiva färger för många tioketoner),
- annorlunda reaktivitetsmönster än karbonylgrupper (se nedan),
- karaktäristiska spektroskopiska signaler—C=S-band i IR uppträder ungefär lägre än karbonylens 1700 cm⁻¹, ofta i området ~1050–1200 cm⁻¹ (ungefärligt), och starka absorptionsband i UV–vis hos konjugerade tioketoner.
Jämförelse med ketoner och thialer
En tioketon är kemiskt nära besläktad med en keton, men skillnader i orbitalenergi och polariserbarhet gör att tioketoner ofta är mer reaktiva i vissa typer av reaktioner. Om en av R‑grupperna är väte är molekylen den svavelanaloga till en aldehyd — denna grupp kallas thial. Thialer är i allmänhet ännu mer reaktiva och svårare att isolera än tioketoner; de tenderar att polymerisera eller reagera snabbt med nukleofiler.
Framställning (syntes)
Vanliga metoder för att omvandla en karbonyl (C=O) till en tiokarbonyl (C=S) kallas thionering. Typiska reagenser och metoder är:
- Lawesson's reagent (LR) — en av de mest använda kemikalierna för thionering av ketoner och esterar.
- Fosforsvavel‑reagenser som P4S10 eller derivat (ibland anges som P2S5) — används också för att ersätta oxygen med svavel.
- Specifika syntetiska vägar: syntes från acylhalogenider, eller konstruktion av tioketonen direkt från byggstenar i flerstegsprocedurer, där steriskt skydd eller konjugation används för att erhålla stabila tioketoner.
Reaktivitet och typiska reaktioner
Tioketoner är generellt mycket reaktiva. Viktiga reaktionstyper är:
- Nukleofil additon till kol‑svavel‑dubbelbindningen (C=S), exempelvis addition av aminer eller tioler.
- Cycloadditionsreaktioner — många tioketoner är utmärkta dienofiler i Diels–Alder‑typ reaktioner (4+2) och deltar också i andra pericykliska reaktioner. Detta förklarar deras benägenhet att bilda cykliska produkter och polymerer.
- Dimerisation och polymerisation — vissa tioketoner reagerar med sig själva via [2+2] eller andra additioner och bildar dimrar eller oligomerer, särskilt om de inte är steriskt skyddade eller konjugerade.
- Reduktion och desulfurering — tioketoner kan reduceras eller omvandlas vidare under desulfurering till motsvarande karbonylföreningar eller till andra reducerade produkter.
Stabilitet och faktorer som påverkar
Stabiliteten varierar mycket med substituenter och konjugation:
- Konjugation med aromatiska ringar eller andra π‑system kan stabilisera tioketonen — ett känt exempel är thiobenzophenone (diphenyltioketone), som är relativt stabil och ofta djupt färgad.
- Steriskt skydd (stora alkylgrupper) hindrar dimerisation och ökar isolerbarheten.
- Okonjugerade eller monosubstituerade tioketoner (eller thialer) är ofta mycket reaktiva och svåra att spara i ren form.
Spektroskopiska kännetecken
- IR: Karakteristisk C=S‑relaterad bandvidd ligger ofta långt under karbonylens 1700 cm⁻¹ (ungefär ~1050–1200 cm⁻¹, beroende på substrat).
- UV–vis: Många tioketoner är starkt färgade på grund av lågt liggande n→π* och π→π* övergångar.
- NMR: De närliggande protonerna/kolatomerna visar liknande skift som i karbonylföreningar, men kemiska skiften påverkas av sulfurs polariserbarhet och konjugation.
Tillämpningar och exempel
Tioketoner används främst som syntetiska intermediärer i organisk kemi och i studier av reaktionsmekanismer. Exempel och användningsområden:
- Syntes av heterocykliska föreningar via cycloadditionsvägar.
- Som färgande eller konjugerade molekyler där C=S‑gruppen ger speciella optiska egenskaper (t.ex. vissa aryltioketoner är djupt färgade).
- Funktionella byggstenar i flerledade synteser där svavelintroduktion ger tillgång till vidare omvandlingar.
Säkerhet och hantering
Många tioketoner och framför allt thialer luktar starkt (svavelhaltigt) och kan vara irriterande eller toxiska. Följ vanliga laboratorierutiner: arbeta i dragskåp, använd skyddsutrustning och undvik inandning och hudkontakt. Stabilitetsproblem (dimerisation, polymerisation) kan kräva låg temperatur eller snabbt vidareförande av produkten till nästa steg i en synteskedja.
Sammanfattningsvis är tioketoner en viktig, men ofta mer reaktiv, analog till ketoner. Deras kemiska egenskaper (polariserbarhet, orbitalenergi och benägenhet till cykliska reaktioner) gör dem intressanta i syntetisk och teoretisk kemi, samtidigt som de kräver särskild uppmärksamhet vid framställning och lagring.
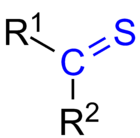
Allmän struktur för en tioketon
Frågor och svar
F: Vad är en tioketon?
S: En tioketon är en molekyl med gruppen R2C=S, vilket är som en keton där syreatomen bytts ut mot en svavelatom.
F: Hur är svavelatomen bunden till kolatomen i en tioketon?
S: Svavelatomen har en dubbelbindning med kolatomen.
F: Varför är tioketoner mycket reaktiva?
S: Tioketoner är mycket reaktiva eftersom de är bra elektrofiler.
F: Vad händer när tioketoner vill bilda ringar?
S: När tioketoner vill bilda ringar gör de det med cykloadditionsreaktioner, liknande Diels-Alder-reaktionen.
F: Vad är en thial?
S: En thial är svavelversionen av en aldehyd. Det är en molekyl med R2C=S och en av R-grupperna är väte.
F: Hur är reaktiviteten hos en thial jämfört med den hos en tioketon?
S: En thial är ännu mer reaktiv än en tioketon.
F: Är tioketoner och tialer stabila molekyler?
S: Många tioketoner är instabila molekyler, medan thialer är ännu mer reaktiva än tioketoner.
Sök