Vad är ett ensamt elektronpar? Definition, egenskaper och betydelse
Upptäck vad ett ensamt elektronpar är — definition, egenskaper och betydelse för molekylers form, reaktivitet och nukleofilbeteende. Praktiska exempel och förklaringar.
Ett ensamt elektronpar är en grupp av två elektroner som inte deltar i någon kemisk bindning mellan atomer. Dessa elektroner finns i atomens yttersta skal, valensskalet, och tillsammans med bindningselektronerna bildar de det totala antalet valenselektroner. I kemisk terminologi kallas sådana elektroner ofta för icke-bindande eller icke-kovalenta elektroner.
Egenskaper
- Energinivå: I allmänhet ligger icke-bindande elektroner (ensamma par) energimässigt högre än bindningselektroner men lägre än antibindande elektroner.
- Rumsupptag: Ensamma par är mer lokaliserade kring en atom och tar ofta mer utrymme än en bindningselektron. Detta påverkar molekylens form.
- Reaktivitet: Ett ensamt par kan ofta användas för att bilda nya bindningar — atomer eller grupper med ensamma par är vanligen Nukleofiler eller Lewis-baser, det vill säga de kan angripa ett elektrofil eller donera ett elektronpar.
Hur du räknar och ritar ensamma par (enkla riktlinjer)
- Bestäm antalet valenselektroner för varje atom.
- Skapa bindningar mellan atomer med par av elektroner (bindningspar).
- Fördela återstående elektroner som ensamma par runt atomerna så att varje atom uppnår oktett (eller annat stabilt arrangemang för lätta element).
- Kontrollera formella laddningar — ensamma par ger ofta upphov till negativ formell laddning om atomen har fler elektroner än i det neutrala tillståndet.
Exempel
- H2O: Syreatomen har två ensamma par (två par icke-bindande elektroner) och två bindningspar — detta ger vatten sin vinklade form.
- NH3: Kvävet har ett ensamt par och tre bindningspar.
- Cl^- (fritt anjon): Kloridjonen har fyra ensamma par (åtta elektroner kring kloratomen) och inga bindningar i den fria jonen.
- I HCl-molekylen har kloratomen vanligtvis tre ensamma par plus ett bindningspar mot väte.
Påverkan på molekylens form (VSEPR)
En modell som ofta används för att förklara molekylers geometri är VSEPR (Valence Shell Electron Pair Repulsion). Enkla principer:
- Alla elektronpar (bindande och icke-bindande) repellerar varandra.
- Ensamma par repellerar andra elektronpar kraftigare än bindningspar, eftersom deras elektronmoln är mer lokaliserade nära centralatomen.
- Detta leder till att bindningsvinklar ofta blir mindre än det ideala värdet när ensamma par finns: t.ex. CH4 (109,5°), NH3 (≈107°), H2O (≈104,5°).
Roll i kemisk reaktivitet och bindningsdannelse
- Nukleofilisk reaktion: Molekyler eller joner med ensamma par fungerar ofta som nukleofiler och kan angripa elektrofiliska centra genom att donera sitt elektronpar och bilda en ny bindning.
- Lewis-syra-bas: En Lewis-bas är en partikel som kan donera ett elektronpar (ensamt par) till en Lewis-syra för att bilda en koordinativ (dativ) bindning.
- Delokalisering och resonans: I vissa system kan ett ensamt par delokaliseras över ett konjugerat system (resonans), vilket påverkar stabilitet och kemisk egenskap. Exempel: en av syreatomerna i karboxylatjonen kan delokaliseras över båda syreatomerna.
- Amider och basstyrka: Ett ensamt par på kväve i en amin kan vara mindre tillgängligt för protonering om det delokaliseras in i en intilliggande karbonylgrupp (som i amider), vilket minskar basstyrkan.
Fysiska konsekvenser
- Poläritet: Ensamma par kan skapa en ojämn fördelning av laddning och därmed bidra till molekylens dipolmoment (t.ex. vatten är polar och har stark dipol på grund av syrets ensamma par).
- Vätebindningar: Ensamma par på elektronegativa atomer (O, N, F) fungerar ofta som vätebindningsacceptorer, vilket påverkar kokpunkter, löslighet och struktur (t.ex. vattenmolekyler bildar vätebindningsnätverk).
Sammanfattning
Ett ensamt elektronpar är två icke-bindande elektroner i valensskalet som påverkar molekylers geometri, reaktivitet och fysikaliska egenskaper. De gör atomer till nukleofiler/Lewis-baser, kan delokaliseras i resonansstrukturer och ofta bestämmer viktiga egenskaper som polaritet och förmåga att bilda vätebindningar. Att kunna identifiera och räkna ensamma par är ett grundläggande steg i att förstå struktur och reaktivitet hos molekyler.
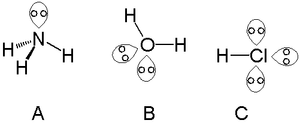
Lonepar i ammoniak (A), vatten (B) och saltsyra (C).
Sök