Molekylära chaperoner – hur de viker och skyddar proteiner
Molekylära chaperoner: hur proteiner viks, skyddas och förhindrar skadlig aggregering — lär dig mekanismerna bakom cellens proteinvård.
Molekylära chaperoner är proteiner som hjälper stora molekyler att vika eller veckla ut sig. De underlättar också omvikning (refolding) av delvis felveckade proteiner och kan hjälpa till att veckla ut proteiner inför degradering eller transport. Vissa chaperoner hjälper till att sätta ihop eller ta isär andra makromolekylära strukturer. En viktig egenskap är att de normalt inte ingår i de slutliga strukturerna när dessa utför sina biologiska funktioner, utan verkar temporärt för att styra eller underlätta korrekt bildning av strukturen. Chaperoner förekommer i många cellulära kompartment — cytosol, cellkärna, endoplasmatiskt retikulum och mitokondrier — och exempel på organellspecifika chaperoner är t.ex. BiP/Grp78 i ER och mtHsp70 i mitokondrier.
Hur chaperoner verkar
En central funktion för chaperoner är att förhindra att nybildade eller skadade polypeptidkedjor klumpar ihop sig till olösliga, icke-fungerande aggregat. De känner igen och binder ofta till exponerade hydrofoba ytor på omogna eller delvis veckade proteiner, ytor som annars skulle leda till oönskad sammangruning. Många chaperoner använder energi från ATP-hydrolys för att ändra konformation och därigenom frigöra eller omforma det bundna substratet. Andra fungerar utan ATP och håller proteiner i ett lösligt, icke-aggregat tillstånd tills andra maskiner kan slutföra vikningen eller degradera proteinet.
Typer av chaperoner
- Holdaser: Håller proteiners veckningstillstånd stabilt och förhindrar aggregering, ofta utan att aktivt vika proteinet.
- Foldaser: Hjälper aktivt till med korrekt vikning. Hit hör bl.a. stora chaperoninkomplex som chaperoniner (t.ex. GroEL/GroES i bakterier och TRiC/CCT i eukaryoter) som bildar en kammare där ett protein kan veckas skyddat från omgivningen.
- Hsp-familjer: Heat-shock-proteiner (Hsp70, Hsp90, små Hsp osv.) som ofta uppregleras vid stress och är centrala för proteinhomeostas.
- Histon- och nukleosomchaperoner: Specialiserade chaperoner som binder histoner och underlättar bildandet och omlokaliseringen av nukleosomer av vikta histoner och DNA. De säkerställer att histoner levereras i rätt skick och monteras korrekt på DNA.
Exempel på mekanismer och komplex
- Chaperoniner (t.ex. GroEL/GroES) skapar en sluten kammare där substratet kan få tid för korrekt veckning; ATP-driven cykling styr öppning och stängning.
- Hsp70-familjen binder korta hydrofoba peptidsekvenser och fungerar ofta tillsammans med co-chaperoner (t.ex. Hsp40/DnaJ) och nucleotide exchange factors för ett koordinerat veckningsarbete.
- Hsp90 fungerar ofta senare i veckningskedjan och hjälper till med mognad av signalproteiner och receptorer; dess aktivitet är även ett läkemedelsmål (t.ex. geldanamycin-derivat).
Det första proteinet som kallades chaperon upptäcktes för sin förmåga att hjälpa till att bygga ihop nukleosomer av vikta histoner och DNA. Dessa chaperoner, särskilt i cellkärnan, sätter ihop vikta underenheter till större strukturer, t.ex. cellorganeller eller multiproteinkomplex, och de medverkar också vid omlokalisering och återanvändning av komponenter vid cellcyklar och DNA-reparation.
Relation till Anfinsens dogm och proteinhomeostas
En viktig funktion för chaperoner är att förhindra att polypeptidkedjor och sammansatta underenheter klumpar ihop sig till klumpar som inte fungerar. Vissa chaperoner är "holdaser" som verkar för att stoppa aggregering. Andra, som kallas "foldaser", hjälper till att vika proteiner som inte kan göra det själva. Sådana proteiner bryter mot Anfinsens dogm i praktiken — Anfinsens princip säger att ett proteins aminosyrasekvens i teorin innehåller all information för veckning, men i den levande cellen sker vikningen under trånga och konkurrerande förhållanden där hjälp av chaperoner ofta krävs.
Biologiska och medicinska konsekvenser
- Chaperoner är centrala för proteostasen — balansen mellan syntes, veckning, transport och degradering av proteiner.
- När chaperonsystemet sviktar eller blir överbelastat uppstår proteinaggregation, vilket är kopplat till sjukdomar som Alzheimers, Parkinsons och Huntingtons sjukdom.
- Mutationer i chaperoner eller autoimmuna reaktioner mot dem kan ge upphov till så kallade chaperonopatier.
- Chaperoner är också intressanta som terapeutiska mål: både förstärkning av chaperonactivity för att motverka aggregation och hämmare (t.ex. mot Hsp90) i cancerterapi undersöks kliniskt.
Sammanfattning
Molekylära chaperoner är mångsidiga och oumbärliga komponenter i cellen som skyddar mot felveckning och aggregation, underlättar korrekt montering av komplex och organeller, och kopplar samman veckning med degradering och intracellulär transport. Deras ATP‑beroende cykler, interaktioner med co-chaperoner och förmåga att skapa skyddade veckningsmiljöer gör dem centrala för cellulär funktion och förhindrande av proteinrelaterade sjukdomar. Forskning om chaperoner fortsätter att ge insikter i cellbiologi och nya möjligheter för medicinsk intervention.
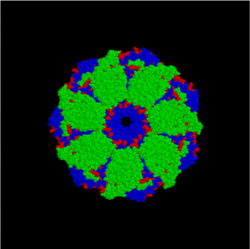
En översikt över ett bakteriellt chaperonkomplex
Frågor och svar
F: Vad är en molekylär chaperon?
S: En molekylär chaperon är ett protein som hjälper till med proteinveckningen.
F: Vilken är den viktigaste rollen för en molekylär chaperon?
S: En molekylär chaperons huvudroll är proteinveckning.
F: Förekommer molekylära chaperoner i makromolekylära strukturer under strukturernas normala funktioner?
S: Nej, molekylära chaperoner förekommer inte i makromolekylära strukturer under deras normala funktioner.
F: Vad är några av de saker som molekylära chaperoner gör med proteiner?
S: Molekylära chaperoner kan veckla över hälften av alla däggdjursproteiner, veckla ut proteiner, sätta ihop proteiner och ta isär proteiner.
F: Vilket var det första protein som kallades för chaperon och vad gjorde det?
S: Det första proteinet som kallades chaperon hjälper till att samla ihop nukleosomer från vikta histoner och DNA.
F: Vilken är en av chaperonernas viktigaste funktioner?
S: En viktig funktion för chaperoner är att förhindra att polypeptidkedjor och underenheter klistrar ihop sig till klumpar som inte fungerar.
F: Vad är skillnaden mellan "holdaser" och "foldaser"?
S: "Holdaser" verkar för att stoppa aggregering, medan "foldaser" hjälper till att vika proteiner som inte kan göra det själva.
Sök