Proteinveckning: vad är det och varför är det viktigt?
Proteinveckning: Lär dig hur proteiner får sin funktionella tredimensionella struktur, varför korrekt veckning är avgörande för funktion och kopplad till sjukdomar.
Proteinveckning är den process genom vilken ett protein får sin funktionella form eller "konformation". Det är huvudsakligen en självorganiserande process. Från en slumpmässig spole viker sig polypeptiderna till sin karakteristiska arbetsform. Strukturen hålls samman av vätebindningar.
Etapperna är:
- Varje protein existerar som en oveckad polypeptid eller slumpmässig spole när det översätts från en sekvens av mRNA till en linjär kedja av aminosyror. Denna polypeptid saknar en utvecklad tredimensionell struktur (vänster sida i den övre figuren).
- Aminosyrorna interagerar med varandra för att skapa en väldefinierad tredimensionell struktur, det veckade proteinet (höger sida i figuren). Detta är känt som det naturliga tillståndet. Den resulterande tredimensionella strukturen bestäms av aminosyrasekvensen (Anfinsens dogm).
Ett protein fungerar inte utan sin korrekta tredimensionella struktur. Vissa delar av proteiner kan dock inte veckas: det är normalt.
Om proteiner inte veckar sig till sin ursprungliga form är de inaktiva och vanligtvis giftiga. Flera sjukdomar tros bero på felveckade proteiner. Många allergier orsakas av proteinernas veckning, eftersom immunförsvaret inte producerar antikroppar för alla möjliga proteinstrukturer.
Varför proteinveckning är viktig
Den tredimensionella formen bestämmer hur proteinet fungerar: enzymers katalytiska centra bildas av exakt ordnade aminosyror, transportproteiner får bindningsytor, och strukturella proteiner får rätt mekaniska egenskaper. Felveckning kan leda till förlust av funktion, aggregation eller bildning av giftiga oligomerer som skadar celler.
Vilka krafter och principer styr veckningen?
Flera fysikaliska krafter samverkar för att forma ett protein:
- Hydrofoba effekten: opolära (hydrofoba) sidokedjor gömmer sig inåt från vatten och driver den övergripande packningen.
- Vätebindningar: stabiliserar sekundärstruktur som alfa-spiraler och beta-flak.
- Jonbindningar/saltbryggor: attraktion mellan laddade sidokedjor bidrar till stabilitet.
- Disulfidbindningar: kovalenta bindningar mellan cysteiner i sällsynta fall stabiliserar strukturen, särskilt i extracellulära proteiner.
- Van der Waals-interaktioner: tätt packade atomer ger ytterligare stabilitet.
Begrepp som Levinthals paradox och energilandskap hjälper förklara hur proteiner snabbt hittar sin stabila form utan att pröva alla möjliga konformationer. I praktiken leds folding av en "funnel"-formad energiyta där intermediära steg och övergångstillstånd finns.
Cellens hjälp: molekylära chaperoner och kvalitetskontroll
Även om många proteiner kan veckas spontant, använder celler chaperoner (t.ex. Hsp70-familjen, chaperoniner som GroEL/GroES) för att:
- Förhindra felveckning och aggregation.
- Ge proteinet tid och miljö att hitta rätt konformation.
- Återveckning eller styra proteiner till degradering via system som ubiquitin-proteasomen eller ER-associerad degradering (ERAD).
Intrinsically disordered proteins (IDPs)
Vissa proteiner eller delar av proteiner är naturligt ofolda (intrinsiskt disordnade). Det är normalt och funktionellt: sådana regioner används ofta i signalering, reglering och bindning där flexibilitet och multipla konformationer är en fördel.
Felveckning, aggregation och sjukdom
Felveckning kan leda till aggregation och bildning av amyloida fibriller eller oligomerer som är toxiska. Exempel på sjukdomar som kopplas till felveckning eller aggregation är:
- Alzheimers sjukdom (beta-amyloid och tau-aggregation).
- Parkinsons sjukdom (alfasynuklein-aggregation).
- Prionsjukdomar (infektiösa prionproteiner med konformationsförändringar).
- Cystisk fibros (felveckning av CFTR leder till degradering och förlust av funktion).
Vid allergier spelar konformationen roll för vilka delar (epitoper) av ett protein som immunförsvaret känner igen. Vissa antikroppar binder konformationella (beroende av veckning) epitoper, varför förändrad veckning kan förändra antigenicitet.
Faktorer som påverkar veckningen
Miljöfaktorer kan störa eller förändra veckningen: temperatur, pH, jonstyrka, närvaro av små ligander, kemiska modifieringar (t.ex. fosforylering, glykosylering) och mutationer i aminosyrasekvensen.
Hur studerar man proteinveckning?
Vanliga experimentella metoder:
- Cirkulär dikroism (CD) för att uppskatta sekundärstruktur.
- Röntgenkristallografi, kärnmagnetisk resonans (NMR) och kryo-elektronmikroskopi (cryo-EM) för tredimensionella strukturer.
- Fluorescensspektroskopi och singelmolekyltekniker (t.ex. smFRET) för att följa kinetik.
- Massaspectrometri och biokemiska analyser för att studera modifieringar och interaktioner.
Prediktion och tillämpningar
Proteinstrukturföutsägelse har gjort stora framsteg (t.ex. metoder som AlphaFold), vilket hjälper förstå funktion, designa läkemedel och syntetiska proteiner. Kunskap om veckning används inom bioteknik, läkemedelsutveckling och sjukdomsforskning.
Sammanfattning
Proteinveckning är central för att proteiner ska fungera korrekt. Den styrs av sekvensen och fysikaliska krafter, understöds i cellen av chaperoner och kvalitetskontrollsystem, och när den går fel kan det leda till sjukdom. Samtidigt finns funktionella ofoldade regioner som är viktiga för biologisk reglering.
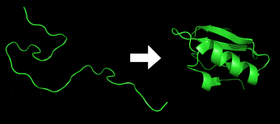
Protein före och efter vikning
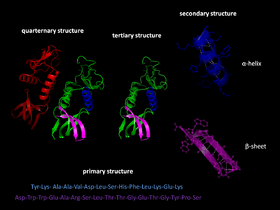
Proteinveckning är det tredje steget i utvecklingen av proteinstrukturen.
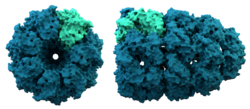
Strukturen hos en chaperonin. Chaperoniner hjälper till med vissa proteinveckningar.
Chaperoner
Chaperoniner är stora proteiner som hjälper till att veckla vissa proteiner efter syntesen. Chaperoner i allmänhet upptäcktes först när de hjälpte histoner och DNA att förenas till nukleosomer. Nukleosomerna är byggstenarna för kromosomerna. Det står nu klart att många cellorganeller byggs upp på detta sätt.
Frågor och svar
Fråga: Vad är proteinveckning?
S: Proteinveckning är den process där en polypeptidkedja omvandlas från en ut vecklad linjär kedja av aminosyror till sin karakteristiska tredimensionella form.
F: Vad håller ihop strukturen?
S: Strukturen hos ett veckat protein hålls samman av vätebindningar.
F: Vilka är stegen i proteinveckningen?
S: Etapperna i proteinveckningen omfattar en oveckad polypeptid eller slumpmässig spole när den översätts från mRNA till en linjär kedja av aminosyror, och sedan interagerar med varandra för att producera en väldefinierad tredimensionell struktur, känd som det ursprungliga tillståndet.
F: Vad händer om proteiner inte veckas korrekt?
S: Om proteiner inte veckar sig till sin ursprungliga form är de inaktiva och vanligtvis giftiga. Detta kan leda till flera sjukdomar och allergier som orsakas av felveckade proteiner som immunförsvaret inte känner igen.
Fråga: Vem löste problemet med proteinveckning år 2020?
S: Den 30 november 2020 löstes proteinveckningsproblemet av företaget DeepMind, som arbetar med artificiell intelligens.
F: Vad är Anfinsens dogm? S: Anfinsens dogm säger att den resulterande tredimensionella strukturen hos ett veckat protein bestäms av dess aminosyrasekvens.
Sök