Elektrofil (Lewis-syra): Definition, egenskaper och exempel i kemi
Lär dig vad elektrofiler (Lewis-syror) är — egenskaper, vanliga exempel som HCl och karbonylgrupper och deras roll i reaktioner med nukleofiler.
I kemi är en elektrofil en partikel som söker elektroner och därför tar emot ett elektronpar från en annan partikel. En enkel formulering är att en elektrofil är en Lewis-syra — alltså en substans som kan ta emot ett elektronpar. I praktiken är många elektrofiler positivt laddade eller polära och har en elektronfattig atom eller ett tomt orbital som kan acceptera elektroner.
Exempelvis står följande uttryck i originalbeskrivningen och är viktiga att känna till:
Inom kemin är en elektrofil en molekyl eller atom som gärna tar emot elektroner från en annan molekyl eller atom. Många elektrofiler har en positiv laddning. De kallas också Lewis-syror. Några exempel på elektrofiler är molekyler där atomerna har en stor skillnad i elektronegativitet, som HCl eller en karbonyl, eller även oxidationsmedel.
Egenskaper hos elektrofiler
- Elektronfattig: Elektrofiler saknar ofta ett fullständigt elektronpar vid den reaktiva centra (t.ex. ett kol i en karbonylgrupp).
- Positiv laddning eller polarisering: Karbokatjoner (R–C+–R), protoner (H+), och polariserade molekyler (t.ex. X–Y där X är mer positivt laddat) är typiska elektrofiler.
- Tomt orbital: Många elektrofiler har ett tomt lågenergi-orbital (t.ex. vacant p-orbital i BF3 eller AlCl3) som tar emot ett elektronpar.
- Reaktivitet: Elektrofili mäts ofta som benägenhet att acceptera elektroner — mer positivt laddade och mindre steriskt hindrade elektrofiler är generellt mer reaktiva.
Vanliga typer av elektrofiler — konkreta exempel
- Protoner (H+) — enkla Brønsted-syror som protolyserar och gör centrum elektrofilt.
- Karbokatjoner — mycket elektrofila intermediärer i många organiska reaktioner.
- Elektronfattiga molekyler — t.ex. HCl (proton ger +), karbonylgruppen (karbonyl) där kolatomen är partiellt positiv.
- Lewis-syror — t.ex. BF3, AlCl3, BCl3, metalljoner som Fe3+, Cu2+. Dessa kan acceptera elektronpar.
- Positiva ioner — t.ex. NO2+, acyliumjoner, haloniumjoner (Br+ i vissa steg).
- Polära elektrofiler — halogenmolekyler (Br2, Cl2) kan bli polariserade vid reaktion med dubbelbindningar och fungera som elektrofiler.
- Oxidationsmedel — t.ex. oxidationsmedel kan fungera som elektrofiler i redoxreaktioner eftersom de accepterar elektroner.
Hur elektrofiler reagerar — mekanismer
Elektrofiler attackerar av en nukleofil, det vill säga en partikel som donerar ett elektronpar. Typiska reaktionstyper där elektrofiler deltar är:
- Additionsreaktioner — t.ex. addition av HBr till en dubbelbindning: protonen (elektrofil) adderar först och ger en karbokatjon, som sedan fångas av bromid (nukleofil). Se även additionsreaktioner.
- Elektrofil aromatisk substitution (EAS) — en aromatisk ring attackeras av en elektrof il (t.ex. NO2+ vid nitrering) och efterföljande rearomatisering ger substituerad aromat.
- SN1-reaktioner — här bildas först en karbokatjon (elektrofil) som sedan reagerar med en nukleofil.
Skillnad mellan Lewis- och Brønsted-begrepp
Lewis-syra (elektrofil) definieras som en elektronparacceptor. Brønsted-syra definieras som en protondonator. Många ämnen kan vara både: en proton (H+) är en Brønsted-syra och fungerar samtidigt som en elektrof il eftersom den accepterar ett elektronpar.
Hur man bedömer elektrofili
- Titta på formell laddning: positivt laddade centra är ofta elektrofiliska.
- Bedöm elektronegativitet och polarisation i bindningar: en karbonyls kol är partiellt positivt och därför elektrofilt.
- Analysera orbitaler: finns det ett tomt lågenergi-orbital som kan ta emot ett elektronpar?
- Effekten av substituenter: elektron-dragande grupper ökar ofta elektrofili vid ett centrum, elektron-släppande grupper minskar den.
Praktiska tips
- I reaktionsmekanismer markera alltid vilket centrum som är elektronrikt (nukleofilt) respektive elektronfattigt (elektrofilt).
- Många katalysatorer för organiska reaktioner fungerar genom att skapa eller stabilisera elektrofila intermediärer (t.ex. Lewis-syror som AlCl3 i Friedel–Crafts-reaktioner).
- Vid laborationer: hantera starka elektrofiler (t.ex. starka syror, acylerande agenter) med försiktighet — de kan reagera våldsamt med nukleofila lösningsmedel.
Sammanfattningsvis är en elektrofil (en Lewis-syra) en partikel som accepterar elektroner. Den kan vara ett positivt laddat jon, en polariserad molekyl eller ett ämne med ett tomt orbital, och den reagerar genom att attackeras av nukleofiler, vilket är centralt i många organiska och oorganiska reaktioner.
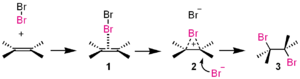
I denna additionsreaktion är brom (Br2 ) elektrofil.
Frågor och svar
F: Vad är en elektrofil?
S: En elektrofil är en molekyl eller atom som gärna tar elektroner från en annan molekyl eller atom.
F: Varför kallas elektrofiler även för Lewis-syror?
S: Elektrofiler kallas även för Lewis-syror eftersom de kan ta emot elektronpar från andra molekyler.
F: Vad är några exempel på elektrofiler?
S: Några exempel på elektrofiler är molekyler där atomerna har en stor skillnad i elektronegativitet, som HCl eller en karbonyl, eller också oxidationsmedel.
F: Hur reagerar nukleofiler med elektrofiler?
S: Nukleofiler reagerar med elektrofiler genom att angripa dem.
F: Vad är en nukleofil?
S: En nukleofil är den motsatta typen av molekyl till en elektrofil. Det är en molekyl eller en atom som gärna donerar elektroner.
F: Hur uppstår additionsreaktioner mellan elektrofiler och nukleofiler?
S: Additionsreaktioner uppstår mellan elektrofiler och nukleofiler när nukleofilen angriper elektrofilen och bildar en ny bindning.
F: Kan en elektrofil ha en negativ laddning?
S: En elektrofil kan ha en positiv laddning, men den kan också ha en partiell positiv laddning eller ingen laddning alls. Den viktigaste egenskapen är att den är villig att acceptera elektroner.
Sök