Atom | den mest grundläggande enheten av materia
En atom är den mest grundläggande enheten i materien. All normal materia på jorden och överallt i universum består av atomer. Detta omfattar fasta ämnen, vätskor och gaser. Det finns ett fast antal olika typer av atomer, som kallas kemiska grundämnen. En atom är den minsta materienhet som kan kombineras med andra atomer för att bilda molekyler och mer komplexa ämnen som har specifika kemiska egenskaper.
Atomer är mycket små, men deras exakta storlek beror på typen. Atomer är mellan 0,1 och 0,5 nanometer stora. En nanometer är ungefär 100 000 gånger mindre än bredden på ett människohår. Detta gör att en atom är omöjlig att se utan specialverktyg. Forskare upptäcker hur de fungerar genom att göra experiment.
Atomer består av tre typer av subatomära partiklar. Dessa är protoner, neutroner och elektroner. Protoner och neutroner är tyngre och befinner sig i mitten av atomen, som kallas kärnan. Kärnan är mycket liten och tät. Den är omgiven av lättviktiga elektroner. Elektronerna dras till kärnan av den elektromagnetiska kraften eftersom de har motsatta elektriska laddningar.
Atomer med samma antal protoner är samma kemiska grundämne. De har mycket likartade egenskaper. Exempel på grundämnen är väte och guld. Omkring 92 grundämnen förekommer i naturen. (Fler har tillverkats artificiellt i ett laboratorium). Atomer med samma antal protoner men olika antal neutroner kallas isotoper. Vanligtvis har en atom samma antal elektroner som protoner. Om en atom har fler eller färre elektroner än protoner kallas den för en jon och har en elektrisk laddning.
Många saker består av mer än en typ av atom. Dessa är kemiska föreningar eller blandningar. Atomer kan förenas genom att skapa kemiska bindningar. En grupp atomer som är sammankopplade genom kemiska bindningar kallas en molekyl. En vattenmolekyl består till exempel av två väteatomer och en syreatom.
Atomer tillverkas, förstörs eller förändras sällan till en annan typ av atom. Detta sker om krafterna inuti atomerna är för svaga för att hålla ihop dem. Dessa förändringar studeras inom kärnfysiken. Atomer kan också gå samman och bilda större atomer vid mycket höga temperaturer, till exempel inuti en stjärna.
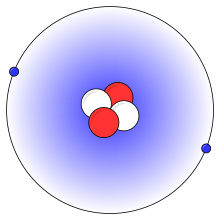
En förenklad bild av en heliumatom med två protoner (röda), två neutroner (vita) och två elektroner (blå).
Historia
Ordet "atom" kommer från grekiskans (ἀτόμος) "atomos", odelbar, från (ἀ)-, inte, och τόμος, ett snitt. Den första person som vi vet använde ordet "atom" är den grekiske filosofen Demokritos, omkring 400 f.Kr. Han trodde att allt var gjort av atomer och att atomer inte kunde brytas i mindre bitar. Atomteorin var till en början ett filosofiskt ämne, med inte mycket egentliga vetenskapliga undersökningar eller studier, förrän kemins utveckling på 1650-talet.
År 1777 definierade den franske kemisten Antoine Lavoisier för första gången begreppet grundämne. Han sade att ett grundämne är varje grundämne som inte kan brytas ner till andra ämnen med kemins metoder. Varje ämne som kan brytas ner är en förening.
År 1803 föreslog den engelske filosofen John Dalton att grundämnena bestod av små, fasta bollar som kallas atomer. Dalton trodde att alla atomer av samma grundämne har samma massa. Han menade att föreningar bildas när atomer av mer än ett grundämne kombineras. Enligt Dalton kombineras atomerna i en viss förening alltid på samma sätt.
År 1827 tittade den brittiske forskaren Robert Brown på pollenkorn i vatten i sitt mikroskop. Pollenkornen såg ut att röra på sig. Brown använde Daltons atomteori för att beskriva mönster i hur de rörde sig. Detta kallades Brownsk rörelse. År 1905 använde Albert Einstein matematik för att bevisa att pollenpartiklarna rördes av rörelsen, eller värmen, hos enskilda vattenmolekyler. Genom att göra detta bevisade han slutgiltigt atomens existens. År 1869 publicerade den ryske vetenskapsmannen Dmitri Mendelejev den första versionen av det periodiska systemet. Det periodiska systemet grupperar grundämnena efter deras atomnummer (hur många protoner de har; detta är vanligtvis detsamma som antalet elektroner). Grundämnen i samma kolumn, eller period, har vanligtvis liknande egenskaper. Till exempel är helium, neon, argon, krypton och xenon alla i samma kolumn och har mycket liknande egenskaper. Alla dessa grundämnen är gaser som inte har någon färg eller lukt. De kan inte heller kombinera sig med andra atomer för att bilda föreningar. Tillsammans är de kända som ädelgaserna.
Fysikern J.J. Thomson var den förste som upptäckte elektroner. Detta skedde när han arbetade med katodstrålar 1897. Han insåg att de hade en negativ laddning och att atomkärnan hade en positiv laddning. Thomson gjorde plommonpuddingmodellen, som sade att en atom var som plommonpudding: den torkade frukten (elektronerna) satt fast i en massa pudding (som har en positiv laddning). År 1909 använde forskaren Ernest Rutherford Geiger-Marsden-experimentet för att bevisa att det mesta av en atom finns i ett mycket litet utrymme, atomkärnan. Rutherford tog en fotoplatta och täckte den med guldfolie. Sedan sköt han alfapartiklar (som består av två protoner och två neutroner som sitter ihop) mot den. Många av partiklarna gick igenom guldfolien, vilket bevisade att atomer till största delen består av tomt utrymme. Elektroner är så små och snabbt rörliga att de inte hindrade partiklarna från att gå igenom. Rutherford upptäckte senare protoner i atomkärnan.
År 1913 introducerade Niels Bohr Bohrmodellen. Denna modell visade att elektronerna rör sig runt kärnan i fasta cirkulära banor. Den var mer exakt än Rutherfordmodellen. Den var dock fortfarande inte helt korrekt. Förbättringar av Bohrmodellen har gjorts efter att den först introducerades.
1925 upptäckte kemisten Frederick Soddy att vissa grundämnen i det periodiska systemet hade mer än en sorts atom, så kallade isotoper. Soddy trodde att isotoper av ett grundämne har olika massa. För att bevisa detta byggde kemisten Francis W. Aston masspektrometern, som mäter massan hos enskilda atomer. Aston bevisade att Soddy hade rätt. Han fann också att varje atoms massa är ett helt tal gånger protonens massa. Detta innebar att det måste finnas någon annan partikel än protoner i atomkärnan. År 1932 sköt fysikern James Chadwick alfapartiklar mot berylliumatomer. Han såg att en partikel sköt ut ur berylliumatomerna. Denna partikel hade ingen laddning, men ungefär samma massa som en proton. Han gav partikeln namnet neutron.
Den mest exakta modellen hittills kommer från Schrödingerekvationen. Schrödinger lärde sig att elektronerna finns i ett moln runt kärnan, som kallas elektronmoln. I elektronmolnet är det omöjligt att veta exakt var elektronerna finns. Schrödingerekvationen används för att bestämma var en elektron sannolikt befinner sig. Detta område kallas för elektronens omloppsbana.
1937 blev den tyske kemisten Otto Hahn den förste som lyckades göra kärnklyvning i ett laboratorium. Han upptäckte detta av en slump när han sköt neutroner mot en uranatom i hopp om att få fram en ny isotop. Han märkte dock att i stället för en ny isotop så förändrades uranet till en bariumatom, en mindre atom än uran. Hahn hade "knäckt" uranatomen. Detta var världens första registrerade kärnklyvningsreaktion. Denna upptäckt ledde så småningom till skapandet av atombomben och kärnkraft, där klyvning sker upprepade gånger och skapar en kedjereaktion.
Under 1900-talet gick fysikerna djupare in i atomens mysterier. Med hjälp av partikelacceleratorer upptäckte de att protoner och neutroner bestod av andra partiklar, så kallade kvarkar.
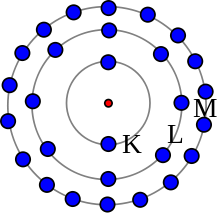
Bohrmodellen är inte exakt, men den är användbar för tanken på elektronskal. Denna atom har 28 elektroner i tre skal.
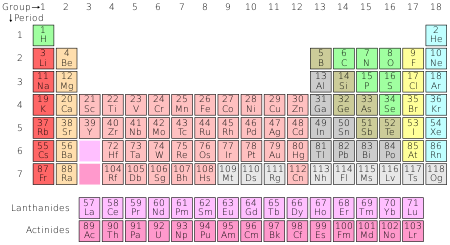
Det periodiska systemet organiserar alla kända kemiska grundämnen.

Ernest Rutherford
Klassificering
Antalet protoner i en atom kallas atomnummer. Atomer av samma grundämne har samma atomnummer. Alla kolatomer har till exempel sex protoner, så kolets atomnummer är sex. I dag känner man till 118 grundämnen. Beroende på hur man räknar antalet finns 90 till 94 grundämnen naturligt på jorden. Alla grundämnen över nummer 94 har endast tillverkats av människor. Dessa grundämnen är organiserade i det periodiska systemet.
Eftersom protoner och neutroner har en mycket likartad massa och elektronernas massa är mycket liten, kan vi kalla antalet protoner och neutroner i en atom för masstal. De flesta grundämnen har flera isotoper med olika masstal. För att namnge en isotop använder vi grundämnets namn följt av dess masstal. En atom med sex protoner och sju neutroner kallas alltså kol-13. Den genomsnittliga massan av alla atomer av ett visst grundämne kallas för dess atommassa eller atomvikt.
Om protoner, neutroner eller elektroner i en atom byts ut mot andra partiklar kan exotiska atomer skapas. Experiment har visat att varje partikel har en motsats som kallas antipartikel. Tillsammans utgör dessa partiklar antimateria. En antimateriaatom skulle tillverkas av antiprotoner, antineutroner och antielektroner (positroner). När en partikel möter sin antipartikel förstörs de båda. Bortsett från detta kan antimateriaatomer vara mycket lika vanliga atomer.
Uppbyggnad och delar
Delar
En atom består av tre huvudpartiklar: proton, neutron och elektron. Väte-1, en isotop av väte, har inga neutroner, bara en proton och en elektron. En positiv vätejon har inga elektroner, bara en proton. Alla andra atomer har minst en proton, en neutron och en elektron vardera.
Elektroner är den överlägset minsta av de tre atompartiklarna. Deras storlek är för liten för att kunna mätas med dagens teknik, och deras massa är ungefär 9,1×10−28 gram (0,00055 atommasseenheter). De har en negativ laddning. Protoner och neutroner är av liknande storlek och vikt som varandra, med en massa på cirka 1,7×10−24 gram (1 atommassenhet). Protoner har en positiv laddning och neutroner har ingen laddning. De flesta atomer har en neutral laddning. Antalet protoner (positiva) och elektroner (negativa) är lika många, så laddningarna balanserar till noll. I joner (olika antal elektroner) är detta dock inte fallet, och de kan ha en positiv eller negativ laddning. Protoner och neutroner består av två typer av kvarkar: uppåtriktade kvarkar och nedåtriktade kvarkar. En proton består av två uppåtriktade kvarkar och en nedåtriktad kvark, och en neutron består av två nedåtriktade kvarkar och en uppåtriktad kvark.
Kärnan
Kärnan är i mitten av en atom. Den utgör mer än 99,9 % av atomens massa. Den är dock mycket liten: ungefär 1 femtometer (10−15 m) i diameter, vilket är ungefär 100 000 gånger mindre än en atoms bredd, så den har en mycket hög densitet. Den består av protoner och neutroner. Vanligtvis i naturen stöter två saker med samma laddning bort eller skjuter bort från varandra. Så länge visste forskarna inte hur de positivt laddade protonerna i kärnan höll ihop. Vi tror nu att attraktionen mellan protoner och neutroner kommer från den starka växelverkan.
Den starka växelverkan är starkast på ett mycket kort avstånd. På detta avstånd bärs den av en partikel som kallas gluon. Gluoner fungerar som lim för att hålla ihop kvarkar i en proton eller neutron. På längre avstånd är den starka växelverkan svagare. Den bärs upp av en partikel som kallas meson. Mesoner drar till sig protoner och neutroner med hjälp av den starka växelverkan. De håller ihop kärnan. Denna speciella form av den starka växelverkan kallas kärnkraft.
Antalet neutroner i förhållande till antalet protoner avgör om kärnan är stabil eller om den radioaktivt sönderfaller. När det finns för många neutroner eller protoner försöker atomen göra antalet mindre eller jämnare genom att ta bort de extra partiklarna. Det gör den genom att avge strålning i form av alfa-, beta- eller gammasönderfall. Kärnor kan också förändras på andra sätt. Kärnklyvning är när kärnan bryts upp i två mindre kärnor, varvid mycket energi frigörs. Det är detta frigörande av energi som gör kärnklyvning användbar för att tillverka bomber och elektricitet i form av kärnkraft. Det andra sättet kärnor kan förändras är genom kärnfusion, när två kärnor förenas eller smälter samman till en större kärna. Denna process kräver extrema mängder energi för att övervinna den elektrostatiska avstötningen mellan protonerna, eftersom de har samma laddning. Sådana höga energier är vanligast i stjärnor som vår sol, som smälter väte till bränsle. När fusionen väl sker frigörs dock mycket mer energi på grund av att en del av massan omvandlas till energi.
Elektroner
Elektroner kretsar runt kärnan. De kallas för atomens elektronmoln. De dras till kärnan på grund av den elektromagnetiska kraften. Elektroner har en negativ laddning och kärnan har alltid en positiv laddning, så de drar till sig varandra.
Enligt Bohrs modell befinner sig vissa elektroner längre bort från kärnan än andra i olika skikt. Dessa kallas för elektronskal. Vi har lärt oss att endast elektronerna i det yttre skalet kan skapa kemiska bindningar. Antalet elektroner i det yttre skalet avgör om atomen är stabil eller vilka atomer den kommer att binda till i en kemisk reaktion. Om en atom bara har ett skal behöver den två elektroner för att vara komplett. Annars behöver det yttre skalet åtta elektroner för att vara komplett.
Bohrmodellen är viktig eftersom den innehåller idén om energinivåer. Elektronerna i varje skal har en viss mängd energi. Skal som ligger längre bort från kärnan har mer energi. När en liten energistöt som kallas för en foton träffar en elektron kan elektronen hoppa in i ett skal med högre energi. Fotonen måste ha exakt rätt mängd energi för att föra elektronen till den nya energinivån. En foton är en ljusstöt, och energimängden bestämmer ljusets färg. Så varje typ av atom absorberar vissa färger av ljus, vilket kallas absorptionsspektrum. En elektron kan också sända ut, eller emittera, en foton och hamna i ett lägre energiskal. Av liknande skäl kommer atomen endast att sända ut vissa färger av ljus, som kallas emissionsspektrumet.
Den fullständiga bilden är mer komplicerad. Till skillnad från jorden som rör sig runt solen rör sig elektronerna inte i en cirkel. Vi kan inte veta exakt var en elektron befinner sig. Vi känner bara till sannolikheten, eller chansen, att den kommer att befinna sig på vilken plats som helst. Varje elektron ingår i en omloppsbana, som beskriver var den sannolikt kommer att befinna sig. Det kan inte finnas mer än två elektroner i en och samma orbital; dessa två elektroner har olika spinn.
För varje skal, numrerat 1, 2, 3 och så vidare, kan det finnas flera orbitaler med olika form. Orbitaltyperna ges bokstäver: s, p, d och f. Det kan också finnas flera orbitaler för en siffer- och bokstavskombination. När fler elektroner läggs till ansluter de sig till orbitaler i ordning från lägsta till högsta energi. Denna ordning börjar på följande sätt: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. En kloratom har till exempel 17 elektroner. Den kommer alltså att ha 2 elektroner i 1s-blocket, 2 elektroner i 2s-blocket, 6 elektroner i 2p-blocket, 2 elektroner i 3s-blocket och 5 elektroner i 3p-blocket. Med andra ord har den 2 elektroner i det första skalet, 8 i det andra skalet och 7 i det tredje skalet.

Olika orbitals former runt en atom
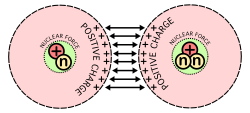
En bild som visar den största svårigheten med kärnfusion: Protoner, som har positiva laddningar, stöter bort varandra när de tvingas samman.
Egenskaper
Storlek och massa
Storleken på en atom beror på storleken på dess elektronmoln. När man rör sig nedåt i det periodiska systemet läggs fler elektronskal till. Som ett resultat av detta blir atomerna större. Om man rör sig åt höger i det periodiska systemet läggs fler protoner till kärnan. Inga elektronskal läggs dock till. Denna mer positiva kärna drar till sig elektroner starkare, vilket gör att atomerna blir mindre. Den största atomen är cesium, som enligt en modell är ungefär 0,596 nanometer bred. Den minsta atomen är helium, som är ungefär 0,062 nanometer bred.
Atomer har en massa på mellan 1,7×10−24 och 4,9×10 −22gram. Vanligtvis mäts massan med hjälp av atommassenheten (amu), även kallad dalton. En amu är exakt 1/12 av massan hos en kol-12 atom, som är 1,7×10−24 gram. Väte-1 har en massa på ungefär 1 amu, och den tyngsta kända atomen, oganesson, har en massa på ungefär 294 amu.
Hur atomer interagerar
När atomerna är långt ifrån varandra drar de till sig varandra. Denna attraktion är starkare för vissa typer av atomer än för andra. Samtidigt får atomernas värme, eller rörelseenergi, dem att ständigt röra sig. Om attraktionen är tillräckligt stark i förhållande till värmemängden kommer atomerna att bilda ett fast ämne. Om attraktionen är svagare kommer de att bilda en vätska, och om den är ännu svagare kommer de att bilda en gas.
Kemiska bindningar är de starkaste formerna av attraktion mellan atomer. Alla kemiska bindningar innebär att elektroner rör sig. Atomer binder vanligtvis till varandra på ett sätt som fyller eller tömmer deras yttre elektronskal. De mest reaktiva grundämnena behöver förlora eller få ett litet antal elektroner för att ha ett fullt yttre skal. Atomer med ett fullt yttre skal, som kallas ädelgaser, brukar inte bilda bindningar.
Det finns tre huvudtyper av bindningar: joniska bindningar, kovalenta bindningar och metalliska bindningar.
- I en jonbindning ger en atom elektroner till en annan atom. Varje atom blir en jon: en atom eller grupp av atomer med en positiv eller negativ laddning. Den positiva jonen (som har förlorat elektroner) kallas katjon och är vanligtvis en metall. Den negativa jonen (som har fått elektroner) kallas en anjon och är vanligtvis en icke-metall. Jonisk bindning resulterar vanligtvis i ett gitter, eller kristall, av joner som hålls samman.
- I en kovalent bindning delar två atomer på sina elektroner. Detta sker vanligtvis när båda atomerna är icke-metaller. Kovalenta bindningar bildar ofta molekyler, i storlek från två atomer till många fler. De kan också bilda stora nätverk, till exempel glas eller grafit. Antalet bindningar som en atom gör (dess valens) är vanligtvis det antal elektroner som behövs för att fylla dess yttre elektronskal.
- I en metallisk bindning rör sig elektronerna fritt mellan många metallatomer. Ett obegränsat antal atomer kan binda sig på detta sätt. Metaller leder elektrisk ström eftersom elektrisk laddning lätt kan flöda genom dem. Atomer i metaller kan röra sig förbi varandra, så det är lätt att böja, sträcka och omforma metaller.
Alla atomer attraherar varandra genom Van der Waals-krafter, som är svagare än kemiska bindningar. Dessa krafter orsakas när elektroner flyttas till en sida av en atom. Denna rörelse ger en negativ laddning till den sidan. Den ger också en positiv laddning till den andra sidan. När två atomer radar upp sina sidor med negativ och positiv laddning kommer de att attrahera varandra.
Trots att atomerna till största delen är tomma rum kan de inte passera genom varandra. När två atomer är mycket nära varandra kommer deras elektronmoln att stötas bort av den elektromagnetiska kraften.
Magnetism
En elektron har en egenskap som kallas magnetiskt moment, som har en riktning och en magnitud (eller storlek). Det magnetiska momentet kommer från elektronens individuella spinn och dess bana runt kärnan. Tillsammans ger elektronernas magnetiska moment ett magnetiskt moment för hela atomen. Detta förklarar atomernas beteende i ett magnetfält.
Varje elektron i en atom har en av två typer av spinn. Om varje elektron paras ihop med en elektron med motsatt spinn kommer spinnarna att upphävas, så atomen kommer inte att ha något bestående magnetiskt moment. Atomer som detta kallas diamagnetiska: de stöts endast svagt bort av ett magnetfält.
Men om vissa elektroner inte är parade har atomen ett bestående magnetiskt moment: den är paramagnetisk eller ferromagnetisk. När atomer är paramagnetiska pekar varje atoms magnetiska moment i en slumpmässig riktning. De dras svagt till ett magnetfält. När atomer är ferromagnetiska verkar de magnetiska momenten hos närliggande atomer på varandra. De pekar i samma riktning. I ett magnetfält kommer de flesta atomer att ställa upp sig i fältets riktning. Ferromagnetiska material som järn, kobolt och nickel dras starkt till ett magnetfält.
Radioaktivt sönderfall
Vissa grundämnen, och många isotoper, har en så kallad instabil kärna. Det betyder att kärnan antingen är för stor för att hålla ihop sig själv eller har för många protoner eller neutroner. När detta händer måste kärnan eliminera den överflödiga massan av partiklar. Det gör den genom strålning. En atom som gör detta kan kallas radioaktiv. Instabila atomer avger strålning tills de förlorar tillräckligt många partiklar i kärnan för att bli stabila. Alla atomer över atomnummer 82 (82 protoner, bly) är radioaktiva.
Det finns tre huvudtyper av radioaktivt sönderfall: alfa, beta och gamma.
- Alfasönderfall innebär att atomen skickar ut en partikel med två protoner och två neutroner. Detta är i huvudsak en heliumkärna. Resultatet är ett grundämne med ett atomnummer som är två mindre än tidigare. Så om till exempel en berylliumatom (atomnummer 4) genomgår alfasönderfall skulle den bli helium (atomnummer 2). Alfasönderfall sker när en atom är för stor och behöver göra sig av med en del massa.
- Betasönderfall är när en neutron förvandlas till en proton eller när en proton förvandlas till en neutron. I det första fallet skjuter atomen ut en elektron. I det andra fallet är det en positron (som en elektron men med positiv laddning). Resultatet är ett grundämne med ett högre eller ett lägre atomnummer än tidigare. Betasönderfall sker när en atom antingen har för många protoner eller för många neutroner.
- Gammasönderfall är när en atom skickar ut en gammastråle eller en våg. Det sker när kärnans energi förändras. Detta sker vanligtvis efter att en atomkärna har genomgått alfa- eller betasönderfall. Det sker ingen förändring av atomens massa, eller atomnummer, utan endast av den lagrade energin inuti kärnan, i form av partikelspinn.
Varje radioaktivt element eller isotop har en halveringstid. Det är hur lång tid det tar för hälften av ett prov av atomer av den typen att sönderfalla tills de blir en annan isotop eller ett annat grundämne.
Klyvning och fusion
Anordningar som använder kärnklyvning börjar med att skjuta neutroner mot atomer. Detta leder till att atomen bryts sönder snabbt. Splittringen av en atom skickar iväg fler neutroner som sedan bryter sönder andra atomer och skapar kedjereaktioner. Denna process ger upphov till enorma mängder värmeenergi. Kedjereaktionen av fission drev de första kärnvapnen (fissionsbomber). Kärnkraftverk är lite annorlunda: saker som kallas kontrollstavar används för att bromsa fissionen. Kontrollstängerna samlar in en del av neutronerna, vilket hindrar en kedjereaktion från att inträffa.
Kärnfusion förekommer främst i solen och andra stjärnor. Den kräver en varm plats men ger ännu mer energi än fission. Detta förklarar solens värme och ljus. Solen smälter nu väte till helium, medan större och hetare stjärnor gör tyngre atomer. Fusionsbomber, eller termonukleära vapen, är de mest kraftfulla kärnvapnen. Forskare försöker göra fusionsreaktorer för kärnkraftverk, men ingen finns ännu.
Kärnfusion och kärnklyvning producerar energi av liknande skäl. Enligt Einsteins berömda formel E = mc2 kan en liten mängd massa omvandlas till en stor mängd energi. När protoner och neutroner möts vid kärnfusion förlorar de en del massa, som de skickar ut som energi. Kärnan kan delas upp i sina protoner och neutroner endast om samma mängd energi tillförs. Denna egenskap hos varje typ av kärna kallas kärnans bindningsenergi. Fusion eller fission skickar ut energi om den totala bindningsenergin ökar. Kärnor i intervallet järn-56 och nickel-62 har den högsta bindningsenergin dividerat med antalet protoner och neutroner, så de går i allmänhet inte igenom fission eller fusion. Större atomer, till exempel uran, går igenom kärnfission eftersom det ökar deras bindningsenergi.
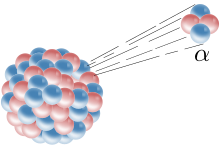
En alfapartikel skjuter ut ur en atomkärna.
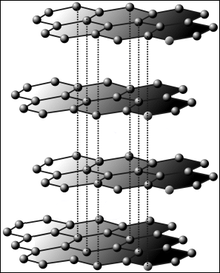
Grafit består av kolatomer i lager. Varje lager hålls samman av kovalenta bindningar. Attraktionen mellan olika lager är en Van der Waals-kraft.
Bildning och förekomst
Nästan alla väteatomer i universum, de flesta heliumatomer och en del litiumatomer skapades strax efter Big Bang. Ännu idag består cirka 90 procent av alla atomer i universum av väte. Större atomer skapas i stjärnor genom kärnfusion, medan de största atomerna skapas i mycket massiva stjärnor eller supernovor. De flesta atomer på jorden skapades av en stjärna som fanns före solen.
Man tillverkar mycket stora atomer genom att slå ihop mindre atomer i partikelacceleratorer. Dessa atomer sönderfaller dock ofta mycket snabbt. Oganesson (grundämne 118) har en halveringstid på 0,89 millisekunder. Det är möjligt att ännu större atomer kommer att skapas i framtiden.
Relaterade sidor
- Atomfysik, för mer information om atomernas fysik.
- Kemi, det område där man studerar allt som består av atomer.
- Elementarpartiklar, de partiklar som utgör atomer och allt annat.
- Kvantmekanik, studiet av små partiklar och hur de interagerar med energi.
- Materiens tillstånd, de olika former i vilka atomer eller molekyler kan finnas.
Frågor och svar
F: Vad är en atom?
S: En atom är den mest grundläggande enheten av materia. Det är den minsta materienhet som kan kombineras med andra atomer för att bilda molekyler och mer komplexa ämnen som har specifika kemiska egenskaper.
F: Hur stora är atomer?
S: Atomer är mycket små, mellan 0,1 och 0,5 nanometer, vilket är ungefär 100 000 gånger mindre än bredden på ett människohår.
F: Vilka är de tre typerna av subatomära partiklar som utgör en atom?
S: De tre typerna av subatomära partiklar som utgör en atom är protoner, neutroner och elektroner. Protoner och neutroner är tyngre och befinner sig i kärnan medan elektroner är lättare och dras till kärnan av elektromagnetisk kraft på grund av sina motsatta elektriska laddningar.
F: Hur många grundämnen förekommer naturligt i världen?
S: Ungefär 92 grundämnen förekommer naturligt i världen.
F: Vad händer när en atom har fler eller färre elektroner än protoner?
S: Om en atom har fler eller färre elektroner än protoner kallas den för en jon och har en elektrisk laddning.
Fråga: Vilken typ av förändringar sker om krafterna inom atomerna blir för svaga för att hålla ihop dem?
S: Om krafterna inom atomerna blir för svaga för att hålla ihop dem kan de ändras till en annan typ av atom eller förstöras helt och hållet.
Sök