PH
pH är en surhetsskala från 0 till 14. Den anger hur surt eller alkaliskt ett ämne är. Mer sura lösningar har lägre pH-värde. Mer alkaliska lösningar har högre pH. Ämnen som inte är sura eller alkaliska (det vill säga neutrala lösningar) har vanligtvis ett pH på 7. Syror har ett pH som är lägre än 7. Alkalier har ett pH som är högre än 7.
pH är ett mått på koncentrationen av protoner (H+) i en lösning. S.P.L. Sørensen introducerade detta begrepp 1909. P står för det tyska potenz, som betyder kraft eller koncentration, och H för vätejonen (H+).
Den vanligaste formeln för att beräkna pH är:
pH = - log 10 [ H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}
[H+] anger koncentrationen av H+-joner (även skrivet [H3O+], motsvarande koncentration av hydroniumjoner), mätt i mol per liter (även kallad molaritet).
Men den korrekta ekvationen är faktiskt:
pH = - log 10 [ a H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}
där a H + {\displaystyle a_{\mathrm {H^{+}} }}
De flesta ämnen har ett pH-värde i intervallet 0-14, även om extremt sura eller alkaliska ämnen kan ha pH < 0 eller pH > 14.
Alkaliska ämnen har istället för vätejoner en koncentration av hydroxidjoner (OH-).
pH-indikatorer
Vissa färgämnen ändrar färg beroende på om de befinner sig i en sur eller alkalisk lösning . pH-indikatorn är en kemisk förening som tillsätts i små mängder till en lösning så att man kan se lösningens pH (surhet eller basiskhet). pH-indikatorn är en kemisk detektor för hydroniumjoner (H3O+) eller vätejoner (H+). Normalt sett får indikatorn lösningen att ändra färg beroende på pH-värdet.
Typiska indikatorer är fenolftalein, metylorange, metylrött, bromtymolblått och tymolblått. De ändrar färg vid olika punkter på pH-skalan och kan användas tillsammans som en universalindikator.
Ett annat sätt är att använda lackmuspapper, som är baserat på en naturlig pH-indikator. Pappret kan berätta hur stark kemikalien är, om det är en starkare syra eller en starkare bas.
Några vanliga pH-värden
| pH | |
| Batterisyra | 0 |
| Magsyra | 1.0 |
| Citronsaft | 2.4 |
| Cola | 2.5 |
| Syrehaltigt vatten | 2.5 - 3.0 |
| Vinäger | 3.0 |
| Apelsin- eller äppeljuice | 3.0 |
| Öl | 4.5 |
| Kaffe | 5.0 |
| Mjölk | 6.6 |
| 7.0 | |
| Blod | 7.35 - 7.45 |
| Vanligt schampo | 8.0 |
| Havsvatten | 8.0 |
| Permanentvåg | 8.5 - 9.2 |
| 9.0 - 10.0 | |
| Hårfärgningsmedel | 9.5 - 10.5 |
| Magiskt rakt | 11.5 |
| Hushållsammoniak | 11.5 |
| Blekmedel | 12.3 |
| Kaustiksoda | 12.7 |
| 13.5 | |
| Avloppsrenare | 14 |
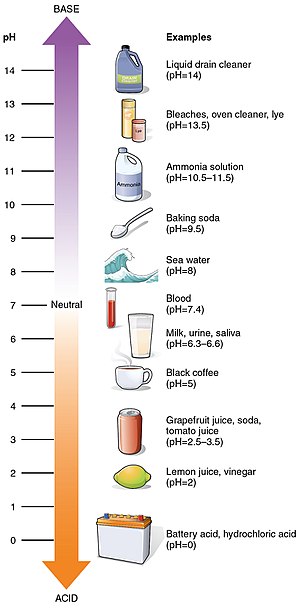
pH-värden för några vanliga ämnen
Neutralisering
Neutralisering kan sammanfattas med ekvationen:
H+
+ OH-
→ H
2O
Relaterade sidor
Frågor och svar
F: Vad är pH?
S: pH är en surhetsskala från 0 till 14 som mäter koncentrationen av protoner (H+) i en lösning. Den anger hur surt eller alkaliskt ett ämne är, där mer sura lösningar har lägre pH och mer alkaliska lösningar har högre pH. Neutrala lösningar har vanligtvis ett pH på 7.
F: Vem introducerade begreppet pH?
S: S.P.L. Sørensen introducerade begreppet 1909.
F: Vad står "p" för i "pH"?
S: "P" står för det tyska ordet potenz, som betyder kraft eller koncentration.
F: Hur beräknar man pH?
S: Den vanligaste formeln för att beräkna pH är att ta den negativa logaritmen av 10 gånger koncentrationen av H+-joner (även skrivet [H3O+], vilket anger lika stora koncentrationer av hydroniumjoner) mätt i mol per liter (eller molaritet). Det finns dock också en ekvation som tar hänsyn till aktivitet i stället för bara koncentration, vilket kan ge andra värden än den vanligare formeln beroende på situationen.
F: Vilket intervall har de flesta ämnen på pH-skalan?
S: De flesta ämnen har ett pH-värde mellan 0 och 14, även om extremt sura eller alkaliska ämnen kan ha ett värde utanför detta intervall (mindre än 0 eller större än 14).
F: Hur skiljer sig alkaliska ämnen från sura ämnen på pH-skalan? S: Alkaliska ämnen har högre värden på skalan på grund av deras koncentration av hydroxidjoner (OH-) i stället för vätejoner som syror har.
Sök
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}](https://www.alegsaonline.com/image/093977a79b6a17e02db4699475930e48c05d6468.svg)
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}](https://www.alegsaonline.com/image/7a631c4037415f3d4483a6cb07e69858b64890fc.svg)