Aktiveringsenergi
Aktiveringsenergin för en kemisk reaktion är den minsta energi som behövs för att reaktionen ska ske. Den har vanligtvis symbolen Ea och mäts i kilojoule per mol. Den kan ses som en barriär mellan reagenserna och produkterna i en reaktion. Aktiveringsenergin är skillnaden i energi mellan övergångstillståndet och startreagenserna.
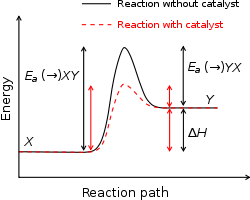
Aktiveringsenergi med och utan katalysator
Arrhenius ekvation
Denna ekvation är ett sätt att beräkna aktiveringsenergin. Den har följande form:
k = A e - E a / R T {\displaystyle k=Ae^{{{-E_{a}}/{RT}}}
Här är k reaktionens hastighetskonstant (som kan mätas med hjälp av kemisk kinetik), A är en frekvensfaktor, R är den universella gaskonstanten och T är temperaturen. Om vi mäter hur snabbt reaktionen går vid olika temperaturer kan vi göra en graf och beräkna aktiveringsenergin med hjälp av denna ekvation.
Katalys
När man använder en katalysator blir aktiveringsenergin mindre. Detta innebär att reaktionen kan gå snabbare vid samma temperatur. Katalysatorn ändrar inte reagensernas eller produkternas energi. Katalysatorn förändras inte heller under reaktionen. Därför kan den användas om och om igen och det behövs bara en liten mängd katalysator.
Sök
