Allotroper av kol – diamant, grafit, egenskaper och användningar
Upptäck allotroper av kol — diamant och grafit: deras egenskaper, industriella och smyckesanvändningar, ledningsförmåga, hårdhet och praktiska tillämpningar.
Det finns flera allotroper av kol. Diamant och grafit är de mest kända. Grafit är en ledare, en halvmetall (ett grundämne som delvis är en metall och en icke-metall, t.ex. svart fosfor och grått selen). Den kan till exempel användas som material i elektroderna i en elektrisk båglampa. Grafit är den mest stabila formen av fast kol som någonsin upptäckts.
Allotropa ämnen är olika former av samma kemiska grundämne. Alla grundämnen består unikt av sina egna atomer. Eventuella fysiska skillnader beror på hur atomerna är sammanfogade. Många grundämnen uppvisar allotropi eftersom atomerna kan kopplas samman på flera olika sätt. Det finns också olika sätt på vilka molekylerna kan arrangeras för att skapa större strukturer.
Diamant är en av de mest kända allotroperna av kol. Dess hårdhet och höga ljusspridning gör den lämplig för användning i smycken. Den har också industriella användningsområden. Diamant är det hårdaste kända naturliga mineralet. Detta gör den till ett utmärkt slipmedel. En diamant behåller också sin lyster väl. Både diamant och grafit har extremt hög smältpunkt, vilket är ovanligt för icke-metalliska element.
Struktur och bindningar
Skillnaderna mellan allotroperna kommer från hur kolatomerna binder till varandra:
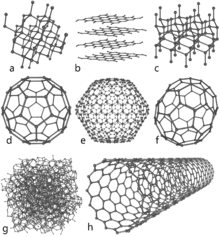
- Diamant: Varje kolatom binder till fyra andra i en tetraedrisk sp3-konfiguration. Det ger en tredimensionell, mycket stabil kristallstruktur (diamantkubiskt nätverk) som är extremt hård och styv.
- Grafit: Består av plana lager av kolatomer bundna i sexhörniga nät i en sp2-hybridisering. Inom varje lager leder fria elektroner bra, medan lagerna hålls samman endast av svaga van der Waals‑krafter och lätt kan glida mot varandra.
- Andra allotroper: Det finns fler former, till exempel grafen (ett enskikt grafit), fullerenes, kolnanorör och amorft kol — alla med egna unika egenskaper.
Fysiska och kemiska egenskaper
- Hårdhet: Diamant är det hårdaste kända naturliga materialet (Mohs ≈ 10). Grafit är mjukt och smörjande (Mohs ≈ 1–2).
- Täthet: Diamant ≈ 3,51 g/cm³, grafit ≈ 2,2 g/cm³.
- Elektrisk ledningsförmåga: Grafit leder elektricitet bra längs lagren men dåligt vinkelrätt mot dem. Diamant är en elektrisk isolator i ren form, men kan göras ledande genom dopning eller defekter.
- Värmeledning: Diamant har mycket hög värmeledningsförmåga (en av de bästa bland naturliga material), medan grafit också leder värme väl i planriktningen.
- Optiska egenskaper: Diamant har hög brytningsindex och stor dispersion, vilket ger dess karakteristiska bländande lyster. Grafit är mörkt och opakt.
- Termisk stabilitet: Kol sublimerar vid mycket höga temperaturer (~3500–4000 °C under vanligt tryck) snarare än att smälta lätt. Grafit är den termodynamiskt mest stabila formen vid normala förhållanden; diamant är metastabil och kan teoretiskt omvandlas till grafit men kräver höga aktiveringsenergier.
- Kemisk resistens: Båda är relativt kemiskt stabila vid låga temperaturer men kan oxideras vid höga temperaturer i närvaro av syre.
Användningsområden
Både natur- och syntetiska former används i många branscher:
- Diamant: Smycken (briljantslipning), slipmedel och skärverktyg (borrkronor, sågklingor), industriella skär- och poleringsverktyg, fönster och linser i extrema miljöer, höghastighetsvärmeledande komponenter, high‑pressure experiments (använder diamantanvällningar i diamantstämplar) samt elektronik i form av dopad eller syntetisk diamant för specialtillämpningar.
- Grafit: Elektrodmaterial i båglampor och ugnar, batterianoder (särskilt i litiumjonbatterier), smörjmedel för höga temperaturer, blyertspennor (grafit + lera), tändstifts- och bromskomponenter, kärnreaktorer (grafit som moderator), samt råmaterial för framställning av grafen och kolnanostrukturer.
- Syntetiska och nanostrukturer: Syntetisk diamant (HPHT, CVD) möjliggör skräddarsydda egenskaper. Grafen och kolnanorör används i forskning och framtida teknikområden: starka kompositer, elektronik, sensorer och energilagring.
Praktiska noteringar och säkerhet
Diamant är värdefullt i smycken och industrin men är känsligt för stötar längs vissa kristallografiska plan där sprickor kan bildas. Grafit är mjukt och lämnar avtryck (pennstreck), men stoft från grafit är i allmänhet inte giftigt — ändå bör inandning av fint kolstoft undvikas av hälsoskäl.
Sammanfattning
Både diamant och grafit består av endast kol, men deras olika atomarrangemang ger helt olika egenskaper: diamant är extremt hårt, tätt och optiskt glänsande, medan grafit är mjukt, elektriskt ledande i plan och fungerar som smörjmedel. Utöver dessa två finns många andra kolallotroper (grafen, fullerenes, nanotuber, amorft kol) som öppnar för ett brett spektrum av tekniska och industriella tillämpningar.
storlek=0.56
Frågor och svar
F: Vad är kolets allotroper?
S: Kolets allotropier är olika former av samma kemiska grundämne.
F: Vilka är de mest kända allotroperna av kol?
S: De mest kända allotroperna av kol är diamant och grafit.
F: Vad är grafit och vilka egenskaper har den?
S: Grafit är en halvmetall och en god ledare. Det är också den mest stabila formen av fast kol som någonsin upptäckts.
Fråga: Vad är allotroper?
S: Allotropier är olika former av samma kemiska grundämne.
F: Varför uppvisar olika grundämnen allotropi?
S: Många grundämnen uppvisar allotropi eftersom atomerna kan kopplas samman på flera olika sätt.
Fråga: Vad är diamant och vilka egenskaper har den?
S: Diamant är en av de mest kända allotroperna av kol. Dess hårdhet och höga ljusspridning gör att den lämpar sig väl för användning i smycken. Det är också det hårdaste kända naturliga mineralet.
F: Vad är smältpunkten för både diamant och grafit?
S: Både diamant och grafit har extremt höga smältpunkter, vilket är ovanligt för ett icke-metalliskt grundämne.
Sök