Sulfon – definition, struktur och användningar i kemi
Upptäck vad sulfon är, dess struktur, framställning och viktiga användningar i kemi — från reaktioner och Julia-olefinsering till lösningsmedel.
En sulfon är en molekyl med en svavelatom som är bunden till två syreatomer. Svavelet har två dubbelbindningar till de två syreatomerna. Den har en enkelbindning med de andra två grupperna. De framställs vanligen genom oxidering av thioetrar.
De används i många viktiga kemiska reaktioner. I Julia olefinering används t.ex. en sulfon för att göra en alken av en aldehyd. De används också ibland som lösningsmedel.
Vad är en sulfon — struktur och nomenklatur
En sulfon kan beskrivas med generell struktur R–S(=O)2–R', där R och R' är organiska grupper (alkyl eller aryl). Sulfornens svavel har formellt hög oxidationstal (+4) och bindningarna till syre har delvis dubbelbindningskaraktär genom resonans. Den geometriska omgivningen kring svavelatomen är ungefär tetraedrisk.
Termen sulfon används ofta i talad svenska om denna funktionella grupp. Relaterade begrepp är sulfonyl (–SO2– som substituent), sulfoxid (R–S(=O)–R', med endast en S=O) och sulfonsyra (R–SO3H), som är kemiskt olika och har andra egenskaper.
Framställning
En vanlig väg till sulf oner är stegvis oxidering av en thioeter (R–S–R'). Först bildas ofta en sulfoxid (R–S(=O)–R') och vidare oxidering ger sulfonen. Vanliga oxideringsmedel är till exempel peroxider och peroxysyror (t.ex. m‑CPBA), väteperoxid eller Oxone, beroende på substrat och villkor.
Kemiska egenskaper och reaktivitet
- Elektronattraktivitet: Sulfonylgruppen är starkt elektron‑dragande, vilket gör alfa‑väten (väten på kolatomer intill S) sura nog för att avprotoneras och bilda stabila karbanjoner. Det utnyttjas i många syntesmetoder.
- Stabilitet: Sulfoner är generellt stabila mot bas och måttlig värme; de är resistenta mot nukleofil attack på svavel under normala förhållanden.
- Resonans och polaritet: S–O‑bindningarna har delvis dubbelbindningskaraktär, vilket ger hög polaritet. Det ger också höga kok- och smältpunkter för många sulf oner.
Användningar i organisk syntes
- Juliareaktioner: Som nämnt ovan används sulf oner i olika varianter av Julia‑olefinationen för att omvandla karbonylföreningar till alkener. Sulfonylmönstret stabiliserar karbanjoner som kan reagera med en aldehyd eller keton och därefter eliminera för att ge alken.
- Alkylationer och byggstenar: Alfa‑positionen till sulfonylgruppen kan avprotoneras och fungera som nukleofil i C–C‑bildande reaktioner.
- Ramberg–Bäcklund‑reaktionen: Alfa‑halogenerade sulf oner kan omvandlas till alken genom en konsert eliminations‑sekvens (användbar för uppbyggnad av dubbelbindningar).
- Reduktiv desulfonylation: Sulfoner kan under vissa förhållanden omvandlas bort (ta bort sulfonylgruppen) för att ge reduktionsprodukter — användbart i strategi för funktionell grupp‑manipulation.
Praktiska användningar och exempel
- Lösningsmedel: Vissa sulf oner, t.ex. sulfolan (tetrametylensulfon), används som polar aprotiska lösningsmedel på grund av höga kokpunkter och god löslighet för polära ämnen.
- Läkemedel och biologiska föreningar: Aromatiska sulf oner förekommer i läkemedel, t.ex. dapsone (använd vid vissa infektioner). Sulfonylgruppen fungerar ibland som bioisoster för andra funktionella grupper.
- Polymerer och högtemperaturmaterial: Polysulf oner (polymerer innehållande sulfonenheter) ger material med god termisk och kemisk stabilitet, användbara i t.ex. membranes och tekniska plaster.
- Industriella tillämpningar: Sulfolan används vid rening av kolväten och som hjälpmedel i raffinaderiprocesser.
Säkerhet och miljö
Som grupp är sulf oner varierande i toxicitet — många enkla sulf oner är relativt lågtoxiska, men specifika föreningar kan vara skadliga eller ge allergiska reaktioner. Vissa sulfoner används i läkemedel och är noggrant utvärderade, medan andra industrikemikalier kräver hantering enligt säkerhetsdatablad. Miljömässigt är nedbrytbarheten beroende av struktur; vissa aromatiska sulfoner kan vara persistenta.
Sammanfattningsvis är sulf oner viktiga och mångsidiga funktionella grupper i organisk kemi: de har karakteristisk struktur R–S(=O)2–R', bildas genom oxidering av thioetrar, spelar stora roller i syntesmetoder (t.ex. Julia‑olefination) och används både som reaktiva byggstenar och som speciallösningsmedel.
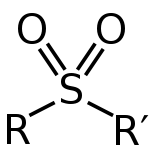
Strukturen hos en sulfon.
Sök