Sulfoxider: struktur, egenskaper, stereokemi och användningar (DMSO)
Sulfoxider: Läs om struktur, egenskaper, stereokemi och användningar — inklusive DMSO, reaktivitet, ligander och lösningsmedlets viktiga roll.
En sulfoxid är en molekyl där en svavelatom är bunden till två kolväten och en syreatom. Den uppstår när man oxiderar thioetrar utan att gå hela vägen till sulfonet. Liksom många molekyler som innehåller svavel kan sulfoxid ibland lukta mycket.
Struktur och bindningssätt
Sulfoxider kan skrivas med den allmänna formeln R–S(=O)–R'. Svavel har en formellt dubbelbindning med syret och enkelbindningar med de två kolatomerna, samtidigt som ett ensamt par finns kvar på svavelatomen. Detta ger en ungefär tetraedrisk/geometrisk ordning runt svavlet (ofta beskriven som trigonal pyramidal) med en tydlig sulfinyl-funktion (S=O).
Bindningen mellan S och O har delvis dubbelbindningskaraktär (dels kan den beskrivas med resonans- eller dativelement), vilket gör S=O-gruppen polar. Sulfoxider är därför ofta polära föreningar med hög dielektricitetskonstant jämfört med många kolväten.
Egenskaper
- Polaritet: Sulfoxider är polar-aprotiska och bra lösningsmedel för både polära och vissa opolära substanser.
- Hydrogenbindningsacceptor: Syreatomen i S=O fungerar som en god vätebindningsacceptor, men sulfoxider saknar vätebundna donorer.
- Fysikaliska egenskaper: Många sulfoxider har relativt höga kok- och smältpunkter jämfört med motsvarande sulfider på grund av polariteten.
- Reaktivitet: Sulfoxider kan bildas lätt genom selektiv oxidation av thioeter och kan vidare oxideras till sulfoner om oxidation fortsätter.
Stereokemi
Det viktiga stereokemiska draget hos sulfoxider är att svavelatomen kan vara chiralt centrum. Svavelatomen binder fyra olika "grupper" i formell mening: två kolgrupper, syret (med sin dubbla bindning) och det fria elektronparet. Därför kan sulfoxider förekomma som enantiomerer (R och S).
Konfigurationsstabiliteten varierar: många alifatiska sulfoxider är tillräckligt stabila för att separera och isolera enantiomera former vid rumstemperatur, medan andra kan epimerisera snabbare beroende på substituenter och omgivning. Denna egenskap gör sulfoxider användbara i asymmetrisk syntes och som kirala auxiliärer eller ligander.
Framställning
Sulfoxider framställs vanligen genom selektiv oxidation av thioetrar med oxidationsmedel som väteperoxid, m‑kklorsyrsyra (mCPBA) eller andra peroxider/oxidanter. För att undvika överoxidation till sulfoner väljs ofta mildare reaktionsbetingelser eller stökiometri som begränsar mängden oxidant.
Användningar
- Lösningsmedel: Sulfoxider, framförallt dimetylsulfoxid (DMSO), används som effektiva polar-aprotiska lösningsmedel i organisk syntes och i biokemin.
- Reagens i syntes: DMSO utnyttjas i flera oxideringsmetoder (t.ex. Swern-oxidation) där DMSO aktiveras för att omvandla alkohol till aldehyd/keton under milda förhållanden.
- Ligander: Sulfoxider är goda ligander för övergångsmetaller, vanligtvis binder de via syreatomen (O-bundna), men bindningsläget kan vara ambident beroende på metall och miljö.
- Biologisk relevans: Oxidation av aminosyran metionin i proteiner ger metionin-sulfoxid — en posttranslationell modifiering som kan påverka proteinfunktioner och som repareras av metionin-sulfoxidreduktaser.
- Industri och medicin: Sulfoxider används i läkemedelskemi som mellanprodukter eller funktionella grupper i aktiva substanser, samt i material- och polymerkemi.
Dimetylsulfoxid (DMSO)
En viktig och välkänd sulfoxid är dimetylsulfoxid, ofta förkortad DMSO. Den används som lösningsmedel för många reaktioner, särskilt inom biokemin, men också som reaktionsmedium i organisk kemi. DMSO är starkt polärt, blandbart med vatten och andra organiska lösningsmedel, och har god förmåga att stabilisera laddade mellanprodukter.
DMSO används också som kryokonserveringsmedel för celler, i formuleringar och som reagens vid selektiva oxidationer. Ett praktiskt säkerhetsaspekt är att DMSO lätt penetrerar huden och kan därför transportera lösta ämnen genom huden; hantera därför DMSO med försiktighet och undvik kontakt med hud vid okända eller giftiga lösningar. DMSO kan också ha en karakteristisk lukt och ge en metallisk/ vitlöksliknande smak vid hudkontakt eller inhalation.
Säkerhet och miljö
Generellt är many sulfoxides kemiskt relativt stabila men hantering kräver vanliga laboratorievanor: undvik inandning av ångor, hudkontakt och ögonkontakt. DMSO bör användas med handskar och i godkänd arbetsmiljö eftersom det kan föra in lösta ämnen genom huden. Kemikalie- och avfallshantering bör följa lokala föreskrifter.
Sammanfattningsvis är sulfoxider en mångsidig klass av svavelföreningar med intressanta strukturella och stereokemiska egenskaper, goda lösningsegenskaper och breda användningsområden inom syntes, katalys och biokemi.
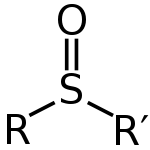
Allmän struktur för en sulfoxid
Frågor och svar
F: Vad är en sulfoxid?
S: En sulfoxid är en molekyl som har en svavelatom bunden till två kolatomer och en syreatom.
F: Varifrån kommer sulfoxid?
S: Sulfoxid kommer från oxidering av tioetrar utan att man går hela vägen till sulfonet.
F: Vad är den allmänna formeln för sulfoxider?
S: Den allmänna formeln för sulfoxider är R-S(=O)-R'.
F: Vilken form har atomen i sulfoxider?
S: Formen på atomen i sulfoxider är tetraedrisk.
F: Kan svavel vara ett kiralt centrum i sulfoxider?
S: Ja, svavel i sulfoxider kan vara ett kiralt centrum.
F: Vad är dimetylsulfoxid och vad används det till?
S: Dimetylsulfoxid, även känt som DMSO, är en viktig sulfoxidmolekyl och används som lösningsmedel för många reaktioner, särskilt inom biokemin.
F: Varför används sulfoxider som bra ligander för övergångsmetaller?
S: Sulfoxider används som bra ligander för övergångsmetaller på grund av deras förmåga att koordinera med metalljoner på grund av elektronparet på svavelatomen.
Sök