Syre | kemiskt element
Syre är ett kemiskt grundämne. Det har symbolen O och atomnummer 8. Det är det tredje vanligaste grundämnet i universum, efter väte och helium.
Syre utgör mer än en femtedel av jordens atmosfär i volym. I luften förenas vanligen två syreatomer för att bilda dioxin (O
2), en färglös gas. Denna gas kallas ofta bara för syre. Den har ingen smak eller lukt. Den är ljusblå när den är flytande eller fast.
Oxygen ingår i chalkogengruppen i det periodiska systemet. Det är en mycket reaktiv ickemetall. Den bildar oxider och andra föreningar med många grundämnen. Syret i dessa oxider och i andra föreningar (främst silikatmineraler och kalciumkarbonat i kalksten) utgör nästan hälften av jordskorpan, räknat i massa.
De flesta levande varelser använder syre för att andas. Många molekyler i levande varelser innehåller syre, t.ex. proteiner, nukleinsyror, kolhydrater och fetter. Syre är en del av vatten, som allt känt liv behöver för att leva. Alger, cyanobakterier och växter tillverkar jordens syrgas genom fotosyntes. De använder solens ljus för att få vätgas från vatten och avger då syre.
I toppen av jordens atmosfär finns ozon (O
3), i ozonskiktet. Det absorberar ultraviolett strålning, vilket innebär att mindre strålning når marken.
Syregas används för tillverkning av stål, plast och textilier. Den har också medicinska användningsområden och används för att andas när det inte finns någon bra luft (t.ex. av dykare och brandmän) och för svetsning. Flytande syre och syrerika föreningar kan användas som raketdrivmedel.
Historia
Syregas (O
2) isolerades av Michael Sendivogius före 1604. Man tror ofta att gasen upptäcktes 1773 av Carl Wilhelm Scheele i Sverige eller 1774 av Joseph Priestley i England. Priestley brukar anses vara huvudupptäckaren eftersom hans arbete publicerades först (även om han kallade den för "dephlogisticated air" och inte trodde att det var ett kemiskt grundämne). Antoine Lavoisier gav gasen namnet oxygène år 1777. Han var den förste som sade att det var ett kemiskt grundämne. Han hade också rätt i att den bidrar till att förbränningen fungerar.
Tidiga experiment
Ett av de första kända experimenten om hur förbränning kräver luft utfördes av greken Philo av Bysans på 200-talet f.Kr. Han skrev i sitt verk Pneumatica att om man vände ett kärl upp och ner över ett brinnande ljus och hällde vatten runt detta kärl så ledde det till att en del vatten gick in i kärlet. Philo trodde att detta berodde på att luften förvandlades till det klassiska elementet eld. Detta är fel. Långt senare kom Leonardo da Vinci fram till att en del luft förbrukades vid förbränning och att detta tvingade in vatten i kärlet.
I slutet av 1600-talet upptäckte Robert Boyle att luft behövs för förbränning. Den engelske kemisten John Mayow kompletterade detta genom att visa att eld endast behöver en del luft. Vi kallar nu detta för syre (O2 ). Han fann att ett ljus som brann i en sluten behållare fick vattnet att stiga för att ersätta en fjortondel av luftens volym innan det slocknade. Samma sak hände när en levande mus sattes i lådan. Utifrån detta kom han fram till att syre används både för andning och förbränning.
Phlogiston-teorin
Robert Hooke, Ole Borch, Mikhail Lomonosov och Pierre Bayen använde syre i experiment på 1600- och 1700-talen. Ingen av dem trodde att det var ett kemiskt grundämne. Detta berodde förmodligen på idén om phlogistonteorin. Det var det som de flesta trodde orsakade förbränning och korrosion.
J. J. Becher kom med teorin 1667 och Georg Ernst Stahl kompletterade den 1731. Enligt phlogistonteorin bestod alla brännbara material av två delar. Den ena delen, kallad phlogiston, avges när ämnet som innehåller den bränns.
Material som lämnar mycket små rester när de brinner, som trä och kol, trodde man att de till största delen bestod av phlogiston. Saker som korroderar, som järn, trodde man att de innehöll mycket lite. Luft ingick inte i denna teori.
Upptäckt
Den polske alkemisten, filosofen och läkaren Michael Sendivogius skrev om något i luften som han kallade för "livets föda", och med detta menade han det som vi nu kallar syre. Sendivogius upptäckte mellan 1598 och 1604 att ämnet i luften är detsamma som han fick fram genom att värma upp kaliumnitrat. Vissa människor anser att detta var upptäckten av syre medan andra inte håller med. Vissa menar att syret upptäcktes av den svenske apotekaren Carl Wilhelm Scheele. Han fick fram syre 1771 genom att värma kvicksilveroxid och några nitrater. Scheele kallade gasen för "eldluft", eftersom det var den enda gas som var känd för att möjliggöra förbränning (gaser kallades för "luft" vid den här tiden). Han publicerade sin upptäckt 1777.
Den 1 augusti 1774 fokuserade den brittiske präst Joseph Priestley solljus på kvicksilveroxid i ett glasrör. Från detta experiment fick han fram en gas som han kallade "dephlogisticated air". Han fann att ljus brann starkare i gasen och att en mus levde längre när den andades in den. Efter att ha andats in gasen sa Priestley att det kändes som vanlig luft, men att hans lungor kändes lättare och lättare efteråt. Hans resultat publicerades 1775. Det är på grund av att hans resultat publicerades först som han ofta sägs ha upptäckt syret.
Den franske kemisten Antoine Lavoisier sa senare att han också hade upptäckt ämnet. Priestley besökte honom 1774 och berättade om sitt experiment. Scheele skickade också ett brev till Lavoisier samma år där han berättade om sin upptäckt.
Lavoisiers forskning
Lavoisier utförde de första viktiga experimenten om oxidation. Han var den förste som förklarade hur förbränning fungerar. Han använde dessa och andra experiment för att bevisa att phlogistonteorin hade fel. Han försökte också bevisa att det ämne som Priestley och Scheele upptäckte var ett kemiskt grundämne.
I ett experiment fann Lavoisier att vikten inte ökade när tenn och luft värmdes upp i en sluten behållare. Han upptäckte också att luften strömmade in när behållaren öppnades. Efter detta fann han att tennets vikt hade ökat med samma mängd som vikten av den luft som strömmade in. Han publicerade sina resultat 1777. Han skrev att luften bestod av två gaser. Den ena kallade han för "vitala luften" (syre), som behövs för förbränning och andning. Den andra (kväve) kallade han "azote", som betyder "livlös" på grekiska. (Detta är fortfarande namnet på kväve på vissa språk, bland annat franska.)
Lavoisier bytte namn på "vital luft" till "oxygène", från grekiska ord som betyder "syratillverkning" eller "syraproducent". Han kallade det så eftersom han trodde att syre fanns i alla syror, vilket är fel. Senare kemister insåg att Lavoisers namn på gasen var fel, men namnet var då för vanligt för att ändras.
"Oxygen" blev det engelska namnet, trots att engelska forskare var emot det.
Senare historia
Enligt John Daltons atomteori hade alla grundämnen en atom och atomer i föreningar var vanligtvis ensamma. Han trodde till exempel felaktigt att vatten (H2 O) bara hade formeln HO. År 1805 visade Joseph Louis Gay-Lussac och Alexander von Humboldt att vatten består av två väteatomer och en syreatom. År 1811 räknade Amedeo Avogadro korrekt ut vad vatten består av med hjälp av Avogadros lag.
I slutet av 1800-talet upptäckte forskarna att luft kunde förvandlas till en vätska och att föreningarna i den kunde isoleras genom att komprimera och kyla den. Den schweiziske kemisten och fysikern Raoul Pictet upptäckte flytande syre genom att förånga svaveldioxid för att göra koldioxid flytande. Denna förångades sedan också för att kyla syrgasen så att den blev flytande. Han skickade ett telegram till den franska vetenskapsakademin den 22 december 1877 och berättade om sin upptäckt.

Lavoisier nedbrytning luft
Egenskaper
Egenskaper och molekylär struktur
Vid normal temperatur och tryck har syre ingen färg, lukt eller smak. Det är en gas med den kemiska formeln O
2 som kallas dioxygen.
I form av syre (eller bara syrgas) är två syreatomer kemiskt bundna till varandra. Denna bindning kan kallas många saker, men kallas helt enkelt en kovalent dubbelbindning. Syregas är mycket reaktiv och kan reagera med många andra grundämnen. Oxider bildas när metallelement reagerar med syre, t.ex. järnoxid, som kallas rost. Det finns många oxidföreningar på jorden.
Allotropes
Den vanligaste allotropen (typen) av syre på jorden kallas dioxygen (O2 ). Detta är den näst största delen av jordens atmosfär, efter dinitrogen (N2 ). O2 har en bindningslängd på 121 pm och en bindningsenergi på 498 kJ/mol På grund av sin energi används O2 av komplexa organismer som djur.
Ozon (O3 ) är mycket reaktivt och skadar lungorna när det andas in. Ozon bildas i den övre atmosfären när O2 förenas med rent syre som bildas när O2 delas av ultraviolett strålning. Ozon absorberar mycket strålning i UV-delen av det elektromagnetiska spektrumet och därför skyddar ozonskiktet i den övre atmosfären jorden från strålning.
Ovanför ozonskiktet (i låga jordbanor) är atomärt syre den vanligaste formen.
Tetraoxygen (O4 ) upptäcktes 2001. Det finns bara under extrema förhållanden när ett stort tryck läggs på O . 2
Fysiska egenskaper
Syre löser sig lättare från luft till vatten än kväve. När det finns samma mängd luft och vatten finns det en molekyl O2 för varje två molekyler N2 (förhållandet 1:2). Detta skiljer sig från luft, där förhållandet mellan syre och kväve är 1:4. Det är också lättare för O2 att lösas upp i sötvatten än i havsvatten. Syre kondenserar vid 90,20 K (-182,95 °C, -297,31 °F) och fryser vid 54,36 K (-218,79 °C, -361,82 °F). Både flytande och fast O2 är genomskinlig med en ljusblå färg.
Syre är mycket reaktivt och måste hållas borta från allt som kan brinna.
Isotoper
Det finns tre stabila isotoper av syre i naturen. De är16 O,17 O och18 O. Ungefär 99,7 % av syret består av isotopen16 O.
Förekomst
Syre är det tredje vanligaste grundämnet i universum, efter väte och helium. Ungefär 0,9 % av solens massa består av syre.
| De tio vanligaste grundämnena i Vintergatan uppskattas spektroskopiskt | ||||
| Z | Element | Massfraktion i delar per miljon | ||
| 1 | 739,000 | 71 × syrets massa (röd stapel) | ||
| 2 | 240,000 | 23 × syrets massa (röd stapel) | ||
| 8 | Syre | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Neon | 1,340 |
| |
Förutom järn är syre det vanligaste grundämnet på jorden (i massa). Det utgör nästan hälften (46-49,2 %) av jordskorpan som en del av oxidföreningar som kiseldioxid och andra föreningar som karbonater. Det är också den viktigaste delen av jordens hav, med 88,8 % av massan. Syregas är den näst vanligaste delen av atmosfären och utgör 20,95 % av dess volym och 23,1 % av dess volym. Jorden är märklig jämfört med andra planeter eftersom en stor del av dess atmosfär består av syrgas. Mars har endast 0,1 % O
2 i volym, och de andra planeterna har mindre än så.
Den mycket större mängden syrgas runt jorden beror på syrecykeln. Fotosyntesen tar väte från vatten med hjälp av energi från solljuset. Detta ger upphov till syrgas. En del av vätet kombineras med koldioxid för att bilda kolhydrater. Respirationen tar sedan syrgas från atmosfären eller vattnet och omvandlar den till koldioxid och vatten.
Använder
Medicinsk
O2 är en mycket viktig del av andningen. Därför används den inom medicinen. Det används för att öka mängden syre i en persons blod så att mer andning kan ske. Detta kan göra att de snabbare blir friska om de är sjuka. Syrebehandling används för att behandla emfysem, lunginflammation, vissa hjärtproblem och alla sjukdomar som gör det svårare för en person att ta upp syre.
Livsuppehållande åtgärder
Lågtrycks-O2 används i rymddräkter som omsluter kroppen med gasen. Rent syre används, men vid ett mycket lägre tryck. Om trycket var högre skulle det vara giftigt.
Industriell
Vid smältning av järnmalm till stål används cirka 55 % av det syre som människan producerar. För att göra detta sprutas gasen O2 in i malmen genom en lans med högt tryck. På så sätt avlägsnas allt svavel och kol från malmen som inte är önskvärt. De avges som svaveloxid och koldioxid. Temperaturen kan stiga till 1 700 °C eftersom det är en exotermisk reaktion.
Omkring 25 % av det syre som produceras av människor används av kemister. Etylen reagerar med O2 för att göra etylenoxid. Detta omvandlas sedan till etylenglykol, som används för att tillverka många produkter som t.ex. frostskyddsmedel och polyester (som sedan kan omvandlas till plast och tyg).
De övriga 20 % av det syre som produceras av människor används inom medicin, metallskärning och svetsning, raketbränsle och vattenrening.

En syrgaskoncentrator i en emphysempatients hus
Föreningar
Syre har oxidationstalet -2 i nästan alla föreningar där det ingår. I några få föreningar är oxidationstalet -1, till exempel i peroxider. Föreningar av syre med andra syretillstånd är mycket ovanliga.
Oxider och andra oorganiska föreningar
Vatten (H
2O) är en väteoxid. Det är den vanligaste oxiden på jorden. Allt känt liv behöver vatten för att leva. Vatten består av två väteatomer som är kovalent bundna till en syreatom (syre har högre elektronegativitet än väte). (Detta är den grundläggande principen för kovalent bindning) Det finns också elektrostatiska krafter (Van de'r Waals-krafter) mellan väteatomerna och intilliggande molekylers syreatomer. Dessa pseudobindningar gör att atomerna befinner sig cirka 15 % närmare varandra än de flesta andra enkla vätskor. Detta beror på att vatten är en polär molekyl (asymmetrisk fördelning av elektroner) på grund av sin böjda form, vilket ger den en övergripande nettofältriktning, främst på grund av syreatomernas två icke-bindande elektronpar, som pressar de bundna H-atomerna längre samman än det linjära arrangemanget med lägre entalpi (se CO2 ). Denna egenskap utnyttjas av mikrovågor för att oscillera polära molekyler, särskilt vatten. Den är också ansvarig för den extra energi som behövs för att skilja H2 0 från varandra.
På grund av syrets höga elektronegativitet kan det skapa kemiska bindningar med nästan alla andra kemiska grundämnen. Dessa bindningar ger upphov till oxider (till exempel reagerar järn med syre för att ge järnoxid). De flesta metallers ytor omvandlas till oxider när de befinner sig i luft. Järnets yta blir till rost (järnoxid) när den ligger i luften under lång tid. Det finns små mängder koldioxid (CO
2) i luften, och den omvandlas till kolhydrater under fotosyntesen. Levande varelser avger den under andningen.
Organiska föreningar
Många organiska föreningar innehåller syre. Några av de klasser av organiska föreningar som innehåller syre är alkoholer, etrar, ketoner, aldehyder, karboxylsyror, estrar och amider. Många organiska lösningsmedel innehåller också syre, till exempel aceton, metanol och isopropanol. Syre finns också i nästan alla biomolekyler som tillverkas av levande organismer.
Syre reagerar också snabbt med många organiska föreningar vid eller under rumstemperatur när autoxidation sker.
Industriell produktion
Varje år hämtas hundra miljoner ton O2 från luften för industriell användning. Industrin använder två huvudsakliga metoder för att framställa syre. Den vanligaste metoden är fraktionerad destillation av flytande luft. N 2avdunstar medan O2 blir kvar som vätska. O2 är den näst viktigaste industrigasen, och eftersom det är mer ekonomiskt, lagras och transporteras syre vanligen som vätska. En liten ståltank med 16 liters vattenkapacitet och ett arbetstryck på 139 bar (2015 psi) rymmer cirka 2150 liter gas och väger 28 kg tomt. 2150 liter syre väger cirka 3 kg.
Den andra huvudsakliga metoden för att framställa syre är att låta en ström av ren, torr luft passera genom ett par zeolitmolekylsikten. Zeolitmolekylsiktena suger upp kvävet. Det ger en gasström som innehåller 90 till 93 % syre.
Syrgas kan också framställas genom elektrolys av vatten till molekylärt syre och väte.

Cyklaren till höger innehåller flytande syre.
Säkerhet
Oxygen's NFPA 704 säger att komprimerad syrgas inte är hälsofarlig eller brandfarlig.
Toxicitet
Vid höga tryck kan syrgas (O2 ) vara farlig för djur, inklusive människor. Den kan orsaka kramper och andra hälsoproblem. Syreförgiftning börjar vanligtvis uppstå vid tryck över 50 kilopascal (kPa), vilket motsvarar ungefär 50 % syre i luften vid standardtryck (luften på jorden innehåller ungefär 20 % syre).
För tidigt födda barn brukade placeras i lådor med luft med hög halt av syre2 . Detta upphörde när vissa barn blev blinda av syret.
Att andas ren O2 i rymddräkter orsakar inga skador eftersom trycket är lägre.
Förbränning och andra risker
Koncentrerade mängder ren O2 kan orsaka en snabb brand. När koncentrerat syre och bränslen kommer nära varandra kan en liten antändning orsaka en enorm brand. Besättningen på Apollo 1 dödades alla av en brand eftersom luften i kapseln hade en mycket hög mängd syre.
Om flytande syre sprids på organiska föreningar, t.ex. trä, kan det explodera.
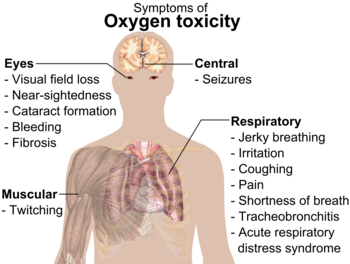
Symtomen på syreförgiftning.
Relaterade sidor
Frågor och svar
F: Vad är symbolen för syre?
S: Symbolen för syre är O.
F: Hur många syreatomer finns vanligtvis i dioxin (O2)?
S: Dioxin (O2) innehåller vanligtvis två syreatomer.
Fråga: Vilken färg har flytande eller fast syre?
S: Flytande eller fast syre är ljusblått.
F: Vilken grupp i det periodiska systemet tillhör syre?
S: Syre tillhör chalkogengruppen i det periodiska systemet.
Fråga: Hur mycket av jordens atmosfär i volymprocent består av syre?
S: Syre utgör mer än en femtedel av jordens atmosfär i volym.
Fråga: Hur producerar växter och andra organismer det mesta av jordens atmosfäriska syre?
S: Växter och andra organismer producerar det mesta av jordens atmosfäriska syre genom fotosyntes, vilket innebär att man använder solljus för att omvandla vatten till väte och frigör syre som en biprodukt.
F: Vilka användningsområden har flytande eller fast form av syre?
S: Flytande eller fast form av syre kan användas som raketdrivmedel, för svetsning, för medicinska ändamål och för att andas när det inte finns någon bra luft att tillgå (t.ex. dykare och brandmän).
Sök