Atomorbitaler – definition, typer och betydelse för elektronkonfiguration
Upptäck atomorbitaler: vad de är, typer (s, p, d, f), kvanttalens roll och betydelsen för elektronkonfiguration och kemins egenskaper.
Atomorbitaler är de områden runt atomkärnan där det är mest sannolikt att elektronerna befinner sig vid en viss tidpunkt. En atomorbital är en matematisk funktion som beskriver det vågliknande beteendet hos en elektron eller ett elektronpar i en atom och ger sannolikhetsfördelningen för var elektronen kan hittas.
Begreppet "orbital" uppstod delvis därför att man tidigare liknade elektronernas rörelser vid planetbanor i ett solsystem, där kärnan motsvarar solen och elektronerna kretsar som planeterna. Idag vet vi att elektroner inte rör sig i bestämda banor utan beter sig enligt kvantmekanikens sannolikheter — orbitalerna beskriver dessa sannolikheter.
Antalet tillgängliga atomorbitaler i ett skal beror på den period grundämnet tillhör och på kvanttalen som definierar varje orbital. Elektroner kan övergå mellan orbitaler när de absorberar eller avger energi; i flerpartikelsystem påverkar dessutom elektronernas inbördes växelverkan orbitalernas energi.
Kvanttal och orbitalernas egenskaper
En atomorbital beskrivs av en uppsättning kvanttal som bestämmer dess storlek, form och orientering:
- Huvudkvanttalet (n) anger skalets storlek och energinivåens ungefärliga avstånd från kärnan (n = 1, 2, 3 ...).
- Bikvanttalet eller azimutalkvanttalet (l) bestämmer orbitalens form (l = 0, 1, 2, ... upp till n−1). Värdena motsvaras ofta av bokstäver: l=0 (s), 1 (p), 2 (d), 3 (f).
- Magnetkvanttalet (m_l) anger orienteringen av orbitalen i rymden (m_l = −l … +l).
- Spinnkvanttalet (m_s) beskriver elektronens spinriktning (m_s = +1/2 eller −1/2). Varje orbital kan maximalt innehålla två elektroner med motsatta spinn.
Orbitalernas energi- och rumsegenskaper bestäms av dessa kvanttal. I väteatomen är alla orbitaler med samma n-degenererade (samma energi), men i flerelektronatomer splittras energierna på grund av elektron-elektroninteraktioner och skärmningseffekter.
Typer av orbitaler och deras former
De vanligaste typerna av orbitaler i grundläggande kemi är:
- s-orbitaler (l = 0): sfäriskt symmetriska runt kärnan. En s-orbital har inga vinkelnoder, men kan ha radiala noder (platser på avstånd där sannolikheten att hitta elektronen är noll).
- p-orbitaler (l = 1): har två lobar med en nodplan genom kärnan; tre p-orbitaler (m_l = −1, 0, +1) ger orienteringar i x-, y- och z-riktning.
- d-orbitaler (l = 2): mer komplexa former med två eller flera lobar och nodytor; ofta viktig för övergångsmetallernas kemi.
- f-orbitaler (l = 3): ännu mer komplexa, viktiga i lantanoider och aktinoider.
Orbitalernas former avspeglar hur elektronens vågfunktion varierar med position. Dessa former förklarar bland annat varför atomer binder sig i vissa riktningar och varför molekylgeometrier får sina typiska former.
Betydelse för elektronkonfiguration och kemi
Ordningen och fyllnaden av orbitaler styr en atoms elektronkonfigurationer, som i sin tur bestämmer många kemiska egenskaper. Några centrala principer är:
- Pauli-exklusionsprincipen: varje orbital kan rymma högst två elektroner med motsatta spinn.
- Aufbau-principen: elektroner fyller orbitalerna från lägre till högre energi (förenklat n+l-regeln).
- Hunds regel: i flera orbitaler med samma energi fylls varje orbital först med en elektron med samma spinn innan parning sker.
Dessa regler förklarar periodiska mönster i det periodiska systemet, valenselektroners roll i kemisk bindning, samt varför vissa oxidationstillstånd och geometriska arrangemang är stabila. Orbitaler ligger också till grund för begrepp som kovalenta och koordinativa bindningar — bindande orbitaler bildas när atomorbitaler överlappar och delokaliserar elektroner mellan atomer.
Visualisering, mätning och tillämpningar
Orbitalkonceptet är teoretiskt men kan påverkas och kontrolleras i experiment genom spektroskopi, röntgen- och elektronmikroskopi samt kvantkemiberäkningar. Spektroskopiska linjer (t.ex. de som tidiga spektroskopister studerade hos alkalimetaler) ger information om energiskillnader mellan orbitaler — historiskt kallades vissa linjer skarpa, huvudsakliga, diffusa och fundamentala, vilket speglade orbitalernas karaktär.
Moderna beräkningsmetoder och visualiseringar visar orbitalernas elektrontäthet och nodytor. Begreppet radiefördelning (sannolikhet att hitta en elektron på ett visst avstånd från kärnan) förklarar till exempel varför s-orbitaler kan penetrera närmare kärnan och påverkas mindre av skärmning.
I molekylära system kombineras atomorbitaler till molekylorbitaler som kan vara bindande, antibindande eller icke-bindande; vidare leder hybridisering (t.ex. sp, sp2, sp3) till riktade orbitaler som förklarar molekylgeometrier i organiska och oorganiska föreningar.
Sammanfattning
Atomorbitaler är centrala i förståelsen av atomers och molekylers struktur och reaktivitet. De är matematiska funktioner som beskriver var elektroner sannolikt befinner sig, bestäms av kvanttal och kommer i olika typer (s, p, d, f) med karakteristiska former och energier. Genom principer som Pauli-exklusion, Aufbau och Hunds regel bestäms hur orbitaler fylls, vilket i sin tur styr kemiska egenskaper, spektroskopi och bindningsbildning.
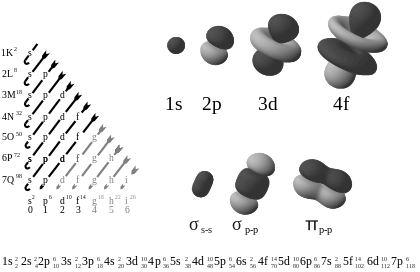
Diagrammet till vänster visar orbitalerna i stigande energiförhållande ordning. Till höger visas exempel på orbitala former.
Relaterade sidor
- Elektronmoln
- Molekylär orbital
Frågor och svar
Fråga: Vad är atomära banor?
S: Atomorbitaler är de områden som omger atomkärnan där det är mest troligt att elektroner finns.
F: Vilken är den matematiska funktion som beskriver elektronernas beteende i en atom?
S: Den matematiska funktion som beskriver elektronernas beteende i en atom är en vågliknande funktion.
F: Varför används ordet "orbital"?
S: Ordet "orbital" används för att beskriva de områden som omger kärnan där elektroner är mest sannolika att finnas eftersom man en gång trodde att elektroner uppförde sig som planeter som kretsar kring solen.
F: Hur definieras antalet atomorbitaler i ett grundämne?
S: Antalet atomära banor i ett grundämne bestäms av grundämnets period.
Fråga: Varför rör sig elektroner mellan olika banor?
S: Elektroner rör sig mellan banor beroende på deras hastighet och antalet andra närvarande elektroner.
F: Vad är en atomorbital i atomteori och kvantmekanik?
S: En atomorbital är ett kvanttal i atomteori och kvantmekanik.
F: Hur många elektroner kan varje atomorbital vara upptagen av?
S: Varje atomorbital kan upptas av en eller två elektroner.
Sök