Färgning i mikroskopi: tekniker för att färga celler och vävnader
Färgning i mikroskopi: praktiska tekniker för att framhäva celler och vävnader — steg, färgämnen och tips för klarare kontrast i biologisk och medicinsk analys.
Färgning används inom mikroskopi för att göra celler och vävnader lättare att se och förstå.
Detta är ett sätt att förbättra kontrasten i den mikroskopiska bilden. Färgämnen och färgämnen används ofta inom biologi och medicin för att framhäva strukturer i biologiska vävnader, ofta med hjälp av olika mikroskop.
Färgning kan göras på levande vävnader (in vivo) eller på döda vävnader (in vitro).
Varför färgar man?
Syftet med färgning är att öka kontrasten så att specifika strukturer blir synliga och lätta att tolka. Färgning kan:
- skilja cellkärnor från cytoplasma,
- identifiera bakterier eller svampar,
- markera bindväv, muskelfibrer eller fett,
- påvisa specifika proteiner eller antigen med hjälp av antikroppar (immunfärgning),
- möjliggöra kvantitativ analys av cellantal, cellcykelfas eller andra parametrar.
Vanliga färgningstekniker
- Hematoxylin och eosin (H&E) – standardfärgning i histologi: hematoxylin färgar cellkärnor blåvioletta, eosin färgar cytoplasma och extracellulär matrix rosa.
- Gramfärgning – används för att dela in bakterier i grampositiva och gramnegativa baserat på cellväggens egenskaper.
- Giemsa – vanligen för blodutstryk och för att påvisa parasiter eller cellmorfologi.
- Periodic acid–Schiff (PAS) – påvisar kolhydratrika strukturer som glykogen och mukopolysackarider.
- Specialfärgningar – t.ex. Masson trichrome (bindväv), silverfärgning (retikulära fibrer, vissa bakterier), Oil Red O (lipider).
- Vitalfärgning – färgar levande celler utan att döda dem, t.ex. trypanblått för att skilja levande från döda celler.
- Fluoroforer och immunofärgning – antikroppar märkta med fluorokromer (t.ex. FITC, Alexa-fluorer) eller DNA-färgämnen som DAPI för att lokalisera specifika molekyler i celler och vävnader; lämpligt för fluorescens- och konfokalmikroskopi.
Grundläggande steg i ett färgningsprotokoll
- Fixering – stabiliserar vävnadsstrukturen och bevarar molekyler; vanliga fixativ är formalin eller paraformaldehyd.
- Inbäddning och snittning – vävnader kan inbäddas i paraffin eller fryses för snittning i mikrotom/fryssnittare.
- Rehydrering/dehydrering – vid paraffinprotokoll måste snitten avparaffiniseras och rehydreras före färgning, och oftast dehydreras före montering.
- Färgning – applicera vald färgningsmetod enligt protokoll; tiden i varje lösning påverkar intensiteten.
- Avfärgning och kontrastfärgning – vissa protokoll kräver avfärgning för att separera komponenter och en kontrastfärg för att förbättra synligheten.
- Montering – snittet täcks med täckglas och monteringsmedium för långsiktig bevarande och mikroskopisk analys.
Val av mikroskop och avläsning
- Ljusfält/brightfield – för H&E och andra traditionella färgningar.
- Fluorescens – krävs för fluoroforbaserade färgningar; ger möjlighet att se flera mål samtidigt med olika filter.
- Konfokal – ger optiska snitt och högre upplösning vid tredimensionell rekonstruktion.
- Fas/kontrast – används ofta för levande celler och gör så att strukturer syns utan färgning eller i kombination med milda vitalfärger.
Kontroller och artefakter
För att säkerställa tillförlitliga resultat behövs kontroller och medvetenhet om vanliga artefakter:
- Använd positiva och negativa kontroller vid immunfärgningar.
- Felaktig fixering kan ge dålig färgning eller maskera antigen (överfixering) eller leda till förlust av strukturer (underfixering).
- Över- eller underfärgning ger svårtolkade preparat.
- Tekniska artefakter som veck, luftbubblor, eller kristallisering av monteringsmedium kan förvränga bilden.
Säkerhet och miljö
Många färgämnen och lösningsmedel är hälsofarliga eller miljöfarliga. Arbeta i dragskåp när så krävs, använd lämplig personlig skyddsutrustning och följ lokala rutiner för avfallshantering.
Tips för bättre färgning
- Följ protokoll noggrant och dokumentera tider och temperaturer.
- Optimera färgningstider för ditt prov och din vävnadstyp.
- Använd färska reagenter och byt ut uttorkade eller kontaminerade lösningar.
- Inkludera alltid lämpliga kontroller för att kunna bedöma färgningens specificitet.
Genom att välja rätt färgningsmetod och optimera protokollet kan man tydligt framhäva de strukturer eller molekyler man vill studera, vilket är avgörande för både diagnostik och forskning.
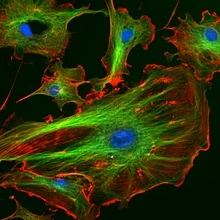
Toppmodern mikroskopi: Kärnorna färgas blått med DAPI, mikrotubbarna markeras grönt av en antikropp och aktinfilamenten markeras rött med phalloidin.

En typisk mikroskopuppställning. Ett färgat prov på ett glasobjektiv monteras på mikroskopets stativ.
Beredning
Död vävnad måste "fixeras" så att den inte förmultnar. Fixeringsmedlet håller strukturen som den är. Efter fixeringen kan vävnaden skäras i tunna skivor och läggas på en serie glasobjektiv. Ibland är det nödvändigt att lösa upp cellmembranen så att stora färgämnesmolekyler kan komma in i cellerna. Standarder publiceras i tidskriften Biotechnic & Histochemistry.
Färgning
Det enklaste sättet är att doppa objektglaset och provet i en färglösning, skölja det och undersöka det. De färgämnen som används är certifierade färgämnen som testats av Biological Stain Commission.
Färgning av bakterier
Gramfärgning används för att klassificera bakterier. Den baseras på sammansättningen av deras cellvägg. Vid gramfärgning används kristallviolett för att färga cellväggarna, jod som betningsmedel och en motfärgning som markerar alla bakterier.
Grampositiva bakterier färgas mörkblått eller violett. Deras cellvägg saknar det sekundära membranet och lipopolysackaridskiktet som finns hos gramnegativa bakterier.
På de flesta gramfärgade preparat är gramnegativa organismer röda eller rosa från motfärgningen.
Färgning av vävnader
Hematoxylin- och eosinfärgning används ofta inom histologin för tunna vävnadssnitt. Hematoxylin färgar cellkärnor blått, medan eosin färgar cytoplasma, bindväv och andra extracellulära ämnen rosa eller rött.
Eosin absorberas starkt av röda blodkroppar och färgar dem klarröda. I ett skickligt framställt H&E-preparat är de röda blodkropparna nästan orange, och kollagen och cytoplasma (särskilt muskler) har olika nyanser av rosa. Hematoxylin färgar cellkärnan och andra sura strukturer (t.ex. RNA-rika delar av cytoplasman och matrisen i hyalint brosk) blått. Däremot färgar eosin cytoplasma och kollagen rosa.
En snabb och enkel färgning som används på blodutstrykningar och mänskliga kindceller är metylenblått, som färgar kärnorna. Det finns många andra specialiserade färgningar, varav vissa är fluorescerande i specialljus.
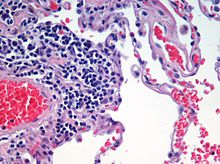
Mikroskopisk bild av ett histologiskt prov av mänsklig lungvävnad färgad med hematoxylin och eosin.
Sök