Periodiska systemet – komplett guide till grundämnen, perioder och grupper
Komplett guide till det periodiska systemet: lär dig om grundämnen, perioder, grupper, egenskaper och mönster — enkel förklaring för studier och nyfikenhet.
Det periodiska systemet för kemiska grundämnen är en förteckning över kända kemiska grundämnen. I tabellen placeras grundämnena i den ordning de har sina atomnummer och börjar med det lägsta atomnumret, väte. Atomnumret för ett grundämne är detsamma som antalet protoner i just den atomkärnan. I det periodiska systemet är grundämnena indelade i perioder och grupper. En rad av grundämnen över hela tabellen kallas för en period. Varje period har ett nummer, från 1 till 8. Period 1 innehåller endast två grundämnen: väte och helium. Period 2 och period 3 har båda åtta grundämnen. Andra perioder är längre. Elementen i en period har på varandra följande atomnummer.
Perioder
En period är en horisontell rad i tabellen. När man går från vänster till höger över en period ökar atomnumret med ett steg i taget och elektronerna läggs i samma energinivå (samma skal). Detta ger flera viktiga mönster:
- Elektronkonfigurationen ändras systematiskt och påverkar kemiskt beteende.
- Atommassor och atomradier förändras ofta gradvis över perioden.
- Reaktivitet och typ av bindningar (jonisk vs. kovalent) varierar från metalliskt till icke‑metalliskt.
Grupper och gruppnummer
En kolumn av element i tabellen kallas en grupp. Det finns 18 grupper i det vanliga periodiska systemet. Varje grupp har ett nummer: från 1 till 18. Elementen i en grupp har elektroner som är ordnade på liknande sätt, enligt antalet valenselektroner, vilket ger dem liknande kemiska egenskaper (de beter sig på liknande sätt). Till exempel kallas grupp 18 för ädelgaserna eftersom de alla är gaser och inte kombineras med andra atomer.
Det finns två system för gruppnummer, ett med arabiska siffror (1, 2, 3) och ett med romerska siffror (I, II, III). De romerska siffrorna användes under större delen av 1900-talet. År 1990 beslutade Internationella unionen för ren och tillämpad kemi (IUPAC) att använda det nya systemet med arabiska siffror för att ersätta de två gamla gruppsystemen med romerska siffror.
Block och elektronkonfiguration
Tabellen delas också in i block — s-, p-, d- och f-block — beroende på vilken typ av orbital som fylls med den yttersta elektronen. Dessa block förklarar många kemiska egenskaper:
- s‑block: grupperna 1–2 (inklusive väte och helium). Har 1–2 valenselektroner.
- p‑block: grupperna 13–18. Innehåller många icke‑metaller och ädelgaser.
- d‑block: övergångsmetallerna (grupperna 3–12). Karaktäriseras av delokaliserade d‑elektroner.
- f‑block: lantanider och aktinider, ofta separerade längst ner av tabellen.
Lantanider, aktinider och syntetiska element
Längst ner i många tabeller finns lantaniderna och aktiniderna — två rader som omfattar de f‑blockselementen. Många aktinider är radioaktiva. Utöver naturligt förekommande grundämnen finns även syntetiska element som tillverkats i laboratorier; dessa har ofta mycket kort halveringstid.
Periodiska trender
Det periodiska systemet visar flera tydliga trender som hjälper kemister att förutsäga egenskaper:
- Atomradie: ökar nedåt i en grupp och minskar åt höger över en period.
- Ioneringsenergi: energin som krävs för att ta bort en elektron — ökar åt höger och minskar nedåt.
- Elektronegativitet: ett mått på förmågan att dra till sig elektroner i en kemisk bindning — generellt större åt höger och överst i tabellen.
- Reaktivitet: varierar beroende på grupp — alkalimetaller (grupp 1) är mycket reaktiva, ädelgaser (grupp 18) är mycket lite reaktiva.
Metaller, metalloider och icke‑metaller
Det periodiska systemet har använts av kemister för att observera mönster och samband mellan grundämnen. Det finns tre huvudgrupper i det periodiska systemet: metaller, metalloider och icke-metaller. Elementen längst ner och längst till vänster i tabellen är till exempel de mest metalliska, och elementen längst upp till höger är de minst metalliska. (Cesium är t.ex. mycket mer metalliskt än helium). Metaller är ofta glänsande, leder värme och elektricitet väl och bildar positiva joner. Icke‑metaller bildar oftare negativa joner eller delar elektroner i kovalenta bindningar. Metalloider har egenskaper mellan dessa två och används ofta i halvledarteknik.
Historia och Mendelejev
Det periodiska systemet uppfanns av den ryske kemisten Dmitry Ivanovich Mendeleyev (1834-1907). Till hans ära har grundämne 101 uppkallats efter honom, mendelevium. Mendelejev sorterade grundämnena efter atomvikt och förutsåg att det skulle finnas tomma platser för ännu oupptäckta element — han förutspådde även egenskaperna hos några av dem, vilket senare bekräftades.
Hur man använder tabellen — praktiska tips
- Identifiera atomnummer för att veta antal protoner och — i neutral atom — även elektroner.
- Titta på gruppnummer för att förutsäga valenselektroner och kemiskt beteende.
- Använd periodnummer för att avgöra hur många elektronskal atomen har.
- Observera block (s, p, d, f) för information om elektronkonfiguration och speciella metalliska egenskaper.
Användningsområden
Det periodiska systemet är ett fundamentalt verktyg inom kemi, fysik, materialvetenskap, biokemi och teknik. Det hjälper forskare och studenter att:
- Förutsäga kemiska reaktioner och bildandet av föreningar.
- Förstå materialegenskaper och utforma nya legeringar eller katalysatorer.
- Söka efter nya, syntetiska element och studera radioaktivitet.
Tillsammans ger alla dessa mönster och indelningar ett kraftfullt sätt att förstå och organisera information om grundämnenas egenskaper och relationer. Det periodiska systemet är därför mer än en tabell — det är ett verktyg för att förutsäga och förklara naturens kemiska beteenden.
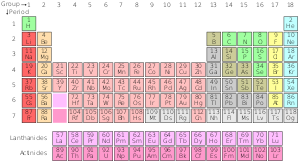
Standardvariationen av det periodiska systemet
Standardperiodiska systemet
| Grupp→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 14 | 15 | 16 | 17 | |||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lanthanider | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktinider | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superaktinider | |||||||||||||||||
| * Lanthanidserien | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Actinid-serien | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Superaktinidserien | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Superaktinidserien | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Superaktinidserien | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Superaktinidserien | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Användning | 180Uon | |||||
| *** Superaktinidserien | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Superaktinidserien | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Superaktinidserien | 211Buu | 212Bub | 213Men | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 miljarder euro | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Kemiska serier i det periodiska systemet
- Alkalimetaller
- Alkaliska jordartsmetaller
- Lanthanider
- Aktinider
- Superaktinider
- Övergångsmetaller
- Dåliga metaller
- Icke-metaller
- Halogener
Tillstånd vid standardtemperatur och standardtryck. Färgen på siffran (atomnumret) ovanför grundämnets symbol visar grundämnets tillstånd vid normala förhållanden.
- De blåa är gaser.
- De gröna är vätskor.
- De svarta är fasta.
- De som har fasta gränser har stabila isotoper (grundämnen).
- De med streckade gränser har endast radioaktiva naturligt förekommande isotoper.
- De med streckade gränser förekommer inte naturligt (syntetiska element).
- De som inte har några gränser är för radioaktiva för att ha upptäckts ännu.
Andra metoder för att visa de kemiska grundämnena
Den version av det periodiska systemet som visas ovan är den mest använda. Andra vanliga versioner visas nedan:
· 
Theodor Benfey ordnade grundämnena i en spiral runt väte. Atomvikten bestämmer elementets position.
· 
Dmitry Ivanovich Mendeleyev använde ett blomsterarrangemang; aktinider och lantanider visas som slingor bredvid huvudgruppen.
· 
Timothy Stove ordnade grundämnena efter kvantnummer.
· ![]()
Betterman ordnade elementen efter deras isoelektriska egenskaper, som kan omvandlas till en polynomisk form.
· 
Triangulär version, av Zmaczynski och Bayley.
· 
Ordnat i en pyramid.
Versioner som använts mindre
- Standardtabellen innehåller de grundläggande uppgifterna. Den visas ovan
- En vertikal tabell för bättre läsbarhet i webbläsare
- I den stora tabellen hittar du grunderna och fullständiga namn på element.
- Den stora tabellen innehåller de grundläggande uppgifterna samt fullständiga namn på grundämnen och atommassor.
- Elektronkonfigurationer
- Metaller och icke-metaller
- Lista över grundämnen: innehåller namn, symbol, atomnummer, atommassa, grupp och period; kan sorteras efter någon av dessa.
- Förteckning över element efter symbol
- Förteckning över grundämnen efter kokpunkt
- Förteckning över grundämnen efter smältpunkt
- Förteckning över grundämnen efter densitet
Relaterade sidor
- Periodiska systemet grupp
- Periodiskt system period
- Utökat periodiskt system
Frågor och svar
F: Vad är det periodiska systemet?
S: Det periodiska systemet är ett diagram som ordnar alla kända kemiska grundämnen i ordning efter deras atomnummer, med väte som nummer ett. Element med liknande egenskaper placeras ofta nära varandra.
F: Hur många perioder och grupper finns det i det vanliga periodiska systemet?
S: Det finns 8 perioder och 18 grupper i det periodiska systemet.
F: Vad har grundämnen i en period gemensamt?
S: Elementen i en period har på varandra följande atomnummer.
Fråga: Vad har grundämnen i en grupp gemensamt?
S: Elementen i en grupp har elektroner som är arrangerade på liknande sätt, enligt antalet valentelektroner, vilket ger dem liknande kemiska egenskaper.
Fråga: Vem uppfann det periodiska systemet?
Svar: Den ryske kemisten Dmitrij Ivanovitj Mendelejev uppfann det periodiska systemet (1834-1907).
Fråga: Vilka är de tre huvudgrupperna i det periodiska systemet?
S: De tre huvudgrupperna i det periodiska systemet är metaller, metalloider och icke-metaller.
F: Hur kan man observera mönster och relationer mellan grundämnena med hjälp av det periodiska systemet?
S: Mönster och relationer mellan grundämnen kan observeras genom att titta på var de förekommer i det periodiska systemet, t.ex. tenderar grundämnen längst ned till vänster att vara mer metalliska än de längst upp till höger.
Sök