Riktad evolution – teknik för att utveckla enzymer och proteiner
Riktad evolution — metod för att utveckla och optimera enzymer och proteiner för industri och medicin; in vivo/in vitro-tekniker och praktiska tillämpningar.
Riktad evolution (DE) är en experimentell metod för att utveckla och optimera enzymer och andra proteiner för industriella, diagnostiska eller medicinska ändamål. Metoden är en form av proteinteknik som efterliknar det naturliga urvalet, men i förkortad och kontrollerad form i laboratoriet.
Grundprincip och arbetsflöde
Den grundläggande idén är att en eller flera gener först görs varierade genom upprepade omgångar av mutationer för att skapa ett stort bibliotek av varianter. Biblioteket kan sedan undersökas med hjälp av någon form av urval eller screening för att isolera de varianter som har önskade egenskaper. De bästa varianterna fungerar som en mall för nästa omgång, vilket leder till successiv förbättring över flera cykler.
Skapande av variation
Variation kan introduceras på flera sätt, vanligast är:
- Felintroducerande PCR (error-prone PCR) som ökar mutationsfrekvensen i målgener.
- Siteriktad eller mättad mutagenes där specifika aminosyror eller positionsser ändras systematiskt.
- Rekombination (t.ex. DNA-shuffling) där segment från flera föräldravarianter kombineras.
- Stora syntetiska bibliotek där randomiserade kodon introduceras i utvalda regioner.
Urval och screening
Efter att biblioteket skapats måste funktionellt förbättrade varianter hittas. Det finns två huvudstrategier:
- Selektionsbaserade metoder där endast celler eller partiklar med önskad funktion överlever eller ger ett klart positivt svar. Exempel är kompartmentaliserad självreplikation (CSR) och överlevnadsselektiva system.
- Skärmning där varje variant testas individuellt eller i hög genomströmning för en mätbar aktivitet. Här används ofta flödescytometri (FACS), mikrofluidiska droppar eller automatiserade assays.
In vivo vs in vitro
DE kan utföras antingen in vivo eller in vitro, och båda har för- och nackdelar.
- In vivo: Varianterna uttrycks i levande celler—vanligtvis bakterier eller jäst. I detta fall transformeras varje cell med en plasmid som bär en individuell medlem av variantbiblioteket. Endast målgenen skiljer sig mellan cellerna, medan övriga cellgener är identiska. Proteinet kan uttryckas i cytoplasman eller på ytan, vilket underlättar urval i en cellulär miljö och är särskilt användbart när produkten ska fungera i levande organismer.
- In vitro: Här används cellfria system för transkription och översättning för att producera proteiner eller RNA fritt i lösning eller i konstgjorda mikrodroppar. Fördelarna är bland annat större kontroll över omgivningsparametrar (t.ex. temperatur, lösningsmedel), möjlighet att arbeta med proteiner som är giftiga för celler, och att man kan skapa mycket större bibliotek (upp till 1015) eftersom DNA:t inte behöver införas i celler.
Tekniker för koppling mellan gen och funktion
En viktig del av riktad evolution är att kunna koppla varje genetisk variant till dess funktionella egenskap. Vanliga tekniker är:
- Fagdisplay och yeast display (yt-display) där proteinet knyts till en fysisk partikels yta för selektion.
- Ribosomdisplay och mRNA-display som tillåter urval av bindande eller katalytiskt aktiva varianter helt in vitro.
- Mikrodroppsteknik och droppmikrofluidik för höggenomströmningstester av enstaka gener i separata reaktionskammare.
Tillämpningar och exempel
Riktad evolution används brett:
- För att förbättra industriella enzymer för biokatalys (högre aktivitet, stabilitet vid hög temperatur eller i organiska lösningsmedel).
- Vid utveckling av terapeutiska proteiner och antikroppar med förbättrade bindningsegenskaper eller lägre immunogenicitet.
- För att skapa biosensorer, ny metabolisk aktivitet eller syntetiska biologi‑komponenter.
Metoden belönades delvis med Nobelpriset i kemi 2018 till Frances H. Arnold för utveckling av riktad evolution av enzymer, som illustrerar teknikens betydelse.
Begränsningar, säkerhet och etik
Trots kraften i DE finns begränsningar: experimenten kan vara tids- och resurskrävande, selektionsmetoder måste vara väl utformade för att välja rätt egenskaper, och det finns alltid en risk att förbättring av en egenskap sker på bekostnad av en annan (trade-offs). Säkerhets- och biosäkerhetsfrågor måste också beaktas när man arbetar med genetiskt material och med levande organismer, och regulatoriska krav styr ofta användning och kommersialisering.
Sammanfattning
Riktad evolution är en flexibel och kraftfull metod för att utveckla nya eller förbättrade proteiner genom att kombinera målinriktad variation med selektion eller höggenomströmningstestning. Genom att välja mellan in vivo och in vitro strategier samt genom att använda moderna skärm‑ och displaytekniker kan forskare och industrin skräddarsy proteiner för ett brett spektrum av praktiska användningar.
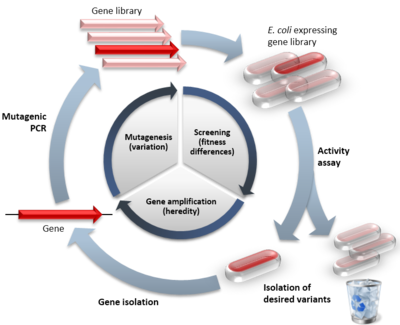
Ett exempel på riktad evolution i jämförelse med naturlig evolution. Den inre cykeln visar de tre stegen i den riktade evolutionen med den efterliknade naturliga processen inom parentes. Den yttre cirkeln visar stegen i ett typiskt experiment. De röda symbolerna anger funktionella varianter, de bleka symbolerna anger varianter med reducerad funktion.
Säkerställande av ärftlighet
När funktionella proteiner har isolerats är det nödvändigt att deras gener också är det, och därför krävs en koppling mellan genotyp och fenotyp.
Detta kan vara kovalent, där mRNA-genen kopplas till proteinet i slutet av översättningen med puromycin.
Alternativt kan proteinet och dess gen förvaras tillsammans eller i emulsionsdroppar. De isolerade gensekvenserna multipliceras sedan genom PCR eller genom transformerade värdbakterier. Antingen den bästa sekvensen eller en pool av sekvenser kan användas som mall för nästa mutageneserunda. De upprepade cyklerna diversifiering-selektion-amplifiering skapar enzymvariationer som är anpassade till selektionsprocessen.

Ett uttryckt protein kan vara kovalent kopplat till sin gen (som i mRNA), till vänster, eller placeras i samma fack som genen, till höger. I båda fallen isoleras den gen som kodar för proteinet.
Utdelat pris
Den amerikanska ingenjören Frances Arnold har vunnit Millenniumpriset för teknik för sin pionjärverksamhet inom riktad evolution.
Frågor och svar
F: Vad är riktad utveckling?
S: Riktad evolution (DE) är en metod som används för att framställa enzymer för industriella eller medicinska ändamål. Det är en form av proteinteknik som efterliknar det naturliga urvalet.
F: Hur fungerar riktad evolution?
Svar: Riktad evolution fungerar genom att en gen genomgår upprepade omgångar av mutationer, vilket skapar ett bibliotek av varianter. Urvalet isolerar sedan gener med önskad funktion, som sedan används som mallar för nästa omgång.
F: Var kan riktad evolution utföras?
S: Riktad evolution kan göras in vivo (i levande celler av bakterier eller jäst) eller in vitro (fritt i lösning eller mikrodroppar).
F: Vilka är fördelarna med riktad evolution in vivo?
S: Att göra riktad evolution in vivo har fördelen att man kan välja egenskaper i en cellulär miljö, vilket är användbart när det utvecklade proteinet eller RNA:t ska användas i levande organismer.
Fråga: Vilka är fördelarna med riktad evolution in vitro?
S: Riktat evolution in vitro har fördelen att det finns fler villkor (t.ex. temperatur, lösningsmedel) och att det går att uttrycka proteiner som skulle vara giftiga för cellerna. Dessutom kan man generera mycket större bibliotek eftersom DNA inte behöver införas i cellerna.
F: Vad begränsar vad som kan göras under ett in vitro-experiment?
S: Storleksgränsen för vad som kan göras under ett in vitro-experiment bestäms ofta av hur mycket DNA som måste föras in i cellerna.
Sök