Karbokatjon
En karbokation är en jon med en positivt laddad kolatom. Den laddade kolatomen i en karbokation är en "sextett" (dvs. den har endast sex elektroner i sitt yttre valensskal i stället för åtta valenselektroner). Kolatomer med åtta valensvalenser har den högsta stabiliteten (oktettregeln). Därför är karbocationer ofta reaktiva och försöker fylla oktetten av valenceelektroner samt återfå en neutral laddning. Logiken skulle säga att karbokationer har 3sp-hybridisering med en tom 3sp-orbital som ger positiv laddning. Karbokationens reaktivitet liknar dock mer 2sp-hybridisering med en trigonal plan molekylär geometri.
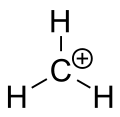
Karbentiumjon av metan

tert-butylkatjon, som visar planär geometri.
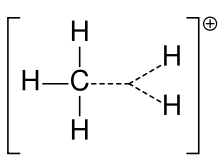
Carboniumjon av metan
Definitioner
En karbokation kallades tidigare ofta för en karboniumjon, men kemister ifrågasätter den exakta innebörden. I dagens kemi är en karbokation en positivt laddad kolatom. Två speciella typer har föreslagits: karbeniumjoner är trevärt och karboniumjoner är fem- eller sexvärt. I läroböcker på universitetsnivå diskuteras karbokationer endast som om de vore karbentiumjoner, eller så diskuteras karbokationer med en flyktig hänvisning till den äldre frasen karbentiumjon eller karbentium- och karbentiumjoner. En lärobok håller än i dag fast vid det äldre namnet karboniumjon för karbentiumjon och reserverar uttrycket hypervalent karbentiumjon för CH5+.
Historia
1891 rapporterade G. Merling att han tillsatte brom till tropyliden (cykloheptatrien) och sedan värmde produkten för att få ett kristallint, vattenlösligt material, C
7H
7Br. Han föreslog ingen struktur för det, men Doering och Knox visade övertygande att det var tropyliumbromid (cykloheptatrienylium). Denna jon förutspås vara aromatisk enligt Hückelregeln.
År 1902 upptäckte Norris och Kehrman oberoende av varandra att färglös trifenylmetanol gav djupt gula lösningar i koncentrerad svavelsyra. Triphenylmetylklorid bildade på samma sätt orange komplex med aluminium- och tennklorider. Adolf von Baeyer upptäckte 1902 den saltliknande karaktären hos de bildade föreningarna.

Han kallade förhållandet mellan färg och saltbildning för halokromi, vilket malakitgrönt är ett utmärkt exempel på.
Karbocationer är reaktiva intermediärer i många organiska reaktioner. Denna idé, som först föreslogs av Julius Stieglitz 1899, vidareutvecklades av Hans Meerwein i hans studie av Wagner-Meerwein-omarrangemanget 1922. Karbocationer har också visat sig vara inblandade i NS1-reaktionen, E1-reaktionen och i omarrangemangsreaktioner, t.ex. Whitmore 1,2-shiftet. Det kemiska etablissemanget var ovilligt att acceptera begreppet karbokation och under lång tid vägrade Journal of the American Chemical Society att publicera artiklar som nämnde karbokationer.
Det första NMR-spektrumet av en stabil karbokation i lösning publicerades av Doering et al. 1958. Det var heptametylbenzenoniumjonen, som framställdes genom att hexametylbensen behandlades med metylklorid och aluminiumklorid. Den stabila 7-norbornadienylkatjonen framställdes av Story et al. 1960 genom att norbornadienylklorid reagerade med silvertetrafluoroborat i svaveldioxid vid -80 °C. NMR-spektrumet visade att den var icke-klassiskt bryggad (den första stabila icke-klassiska jon som observerades).
1962 observerade Olah direkt tert-butylkarbokationen med hjälp av kärnmagnetisk resonans som en stabil art vid upplösning av tert-butylfluorid i magisk syra. Norbornylkatjonens NMR rapporterades först av Schleyer et al. och Saunders et al. visade att den genomgår protonförvrängning över en barriär.
Egenskaper
I organisk kemi är en karbokation ofta målet för nukleofila angrepp av nukleofila ämnen som hydroxyljoner (OH-joner−) eller halogenjoner.
Karbocationer klassificeras som primära, sekundära eller tertiära beroende på antalet kolatomer som är bundna till det joniserade kolet. Primära karbocationer har ett eller noll kolatomer bundna till det joniserade kolet, sekundära karbocationer har två kolatomer bundna till det joniserade kolet och tertiära karbocationer har tre kolatomer bundna till det joniserade kolet.
Karbokationens stabilitet ökar med antalet alkylgrupper som är bundna till det laddningsbärande kolet. Tertiära karbokationer är stabilare (och bildas lättare) än sekundära karbokationer. Primära karbokationer är mycket instabila eftersom joniserade kolväten av högre ordning stabiliseras genom hyperkonjugering, medan osubstituerade (primära) kolväten inte gör det. Reaktioner som NS1-reaktionen och E1-eliminationsreaktionen inträffar därför normalt inte om en primär karbokation skulle bildas. Ett undantag från detta inträffar när det finns en kol-kol dubbelbindning bredvid det joniserade kolet. Sådana katjoner som allylkatjon CH=CH-CH22+ och bensylkatjon6 CH-CH52+ är stabilare än de flesta andra karbokationer. Molekyler som kan bilda allyl- eller bensylkarbokeringar är särskilt reaktiva.
Karbocationer genomgår omarrangemangsreaktioner från mindre stabila strukturer till lika stabila eller mer stabila strukturer med hastighetskonstanter på över 10/sek9. Detta faktum försvårar syntetiska metoder för många föreningar. När t.ex. 3-pentanol värms upp med vattenhaltig HCl ombildas den ursprungligen bildade 3-pentylkarbokationen till en statistisk blandning av 3-pentyl och 2-pentyl. Dessa katjoner reagerar med kloridjonen för att producera ungefär 1/3 3-chloropentan och 2/3 2-chloropentan.
Vissa karbokationer, t.ex. norbornylkatjonen, uppvisar mer eller mindre symmetrisk trecentrumbindning. Kationer av detta slag har kallats icke-klassiska joner. Energidifferensen mellan "klassiska" karbokeringar och "icke-klassiska" isomerer är ofta mycket liten, och det finns i allmänhet liten, om ens någon, aktiveringsenergi vid övergången mellan "klassiska" och "icke-klassiska" strukturer. Den "icke-klassiska" formen av 2-butylkarbokationen är i huvudsak 2-buten med en proton direkt ovanför centrum av vad som skulle vara kol-kol-dobbelbindningen. "Icke-klassiska" karbokationer var en gång i tiden föremål för stora kontroverser. Ett av George Olahs största bidrag till kemin var att lösa denna kontrovers.
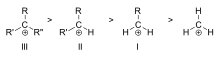
Stabilitetsordning för exempel på tertiära (III), sekundära (II) och primära (I) alkylkarbokationer
Specifika karbocationer
Cyklopropylkarbinylkatjoner kan studeras med NMR:

I NMR-spektrumet för ett dimetylderivat finns två icke-kvalitativa signaler för de två metylgrupperna, vilket tyder på att den molekylära konformationen för denna katjon inte är vinkelrät (som i A) utan tvådelad (som i B), med den tomma p-orbitalen och cyklopropylringssystemet i samma plan:

Enligt teorin om böjda bindningar förklaras denna preferens genom att anta en gynnsam överlappning av orbitalerna mellan de fyllda böjda bindningarna av cyklopropan och den tomma p-orbitalen.
Frågor och svar
Fråga: Vad är en karbokation?
S: En karbokation är en jon med en positivt laddad kolatom.
F: Vad är det yttre valensskalet hos en karbokation?
S: Det yttre valensskalet hos en karbokation har endast sex elektroner i stället för de stabila åtta valenselektronerna.
Fråga: Varför är karbokationer ofta reaktiva?
Svar: Karbokationer är ofta reaktiva eftersom de försöker fylla oktetten av valenceelektroner och återfå en neutral laddning.
Fråga: Vilken är den maximala stabiliteten för kolatomer?
Svar: Kolatomer har maximal stabilitet när de har åtta valenceelektroner.
Fråga: Vad är en sextett i kemi?
Svar: En sextett är en term som används för att beskriva en kolatom i en karbokation som endast har sex elektroner i sitt yttre valensskal i stället för de stabila åtta valenselektronerna.
F: Vad är hybridiseringen och den molekylära geometrin hos en karbokation?
Svar: Även om logiken skulle antyda att karbokationer har sp3-hybridisering med en tom sp3-orbital som ger en positiv laddning, liknar deras reaktivitet mer sp2-hybridisering med en trigonalplan molekylär geometri.
F: Vad är oktettregeln?
S: Oktettregeln är en princip inom kemin som säger att atomer tenderar att bilda kemiska bindningar med andra atomer som gör det möjligt för båda atomer att ha en stabil uppsättning av åtta valenceelektroner.
Sök