Hemoglobin – syretransport i röda blodkroppar: struktur och funktion
Upptäck hemoglobinets struktur och funktion i röda blodkroppar — hur järnhaltigt protein transporterar syre, binder koldioxid och påverkar hälsa.
Hemoglobin (eller hemoglobin) är ett protein i röda blodkroppar som innehåller järn. Det används för att transportera syre runt i människokroppen. Hemoglobin finns i de röda blodkropparna hos alla ryggradsdjur utom vitblodiga fiskar. Det förekommer också i vissa ryggradslösa djur. Vissa andra ryggradslösa djur använder andra kemikalier, t.ex. hemocyanin.
Hemoglobin deltar även i transporten av andra gaser. Det transporterar en del av kroppens koldioxid (ca 20–25 % av den totala mängden) som så kallat karbaminohemoglobin; den största delen av koldioxiden transporteras dock i form av bikarbonat i plasma.
Röda blodkroppar får sin färg från hemoglobin, som är rött. Det finns miljontals hemoglobinmolekyler i varje röd blodkropp och miljontals röda blodkroppar i människokroppen. När hemoglobin har syre bundet kallas det oxyhemoglobin.
Struktur
Mänskligt hemoglobin är en tetramer bestående av fyra globinkedjor (två alfa- och två beta-kedjor i det adulta hemoglobinet HbA). Varje globinkedja bär en heme-grupp, en porfyrinring med en centralt placerad Fe2+ (järn) som kan binda en syremolekyl. Det innebär att en hemoglobinmolekyl kan binda upp till fyra O2-molekyler samtidigt.
Heme-järnet måste vara i järn(II)-form (Fe2+) för att reversibelt binda syre; när det oxideras till järn(III) (Fe3+) bildas methemoglobin, som inte kan transportera syre. Olika varianter av globinkedjor finns hos foster (t.ex. gamma-kedjor i HbF) och hos personer med ärftliga tillstånd (t.ex. sickle-cell och thalassemi).
Funktion och reglering
- Kooperativ bindning: Hemoglobin visar kooperativitet — bindningen av en O2-molekyl ökar affiniteten för nästa O2. Detta ger en sigmoid syre-dissociationskurva som möjliggör effektiv upptagning i lungorna och frisättning i vävnader.
- Allosteriska effekter: pH (Bohr-effekten), koldioxid, kroppstemperatur och 2,3‑bisfosfoglycerat (2,3‑BPG) påverkar hemoglobinets syreaffinitet. Lägre pH eller högre koldioxid och 2,3‑BPG sänker affiniteten och främjar syreavgivning i metabolt aktiva vävnader.
- Koldioxidtransport: Förutom att omvandlas till bikarbonat kan koldioxid binda till aminosyrornas N-terminaler i globinkedjorna och transporteras som karbaminohemoglobin.
- Syremättnad: Arteriell syremättnad (SaO2) mäts ofta med pulsoximetri och talar om hur stor andel av hemoglobinets bindningsställen som är upptagna av syre.
Klinisk betydelse
Hemoglobinnivåer är viktiga i bedömningen av blodets syretransporterande kapacitet. Normala värden varierar men ungefärliga intervall är:
- Män: cirka 130–170 g/L (13,0–17,0 g/dL)
- Kvinnor: cirka 120–150 g/L (12,0–15,0 g/dL)
Avvikelser ger tillstånd som anemi (lågt Hb) eller polycytemi (högt Hb). Ärftliga mutationer i globingenen kan leda till sjukdomar som sicklecellanemi (en punktmutation i beta‑kedjan som gör att hemoglobinet polymeriserar under lågt syretryck) och olika former av thalassemi (minskad syntes av en eller flera globinkedjor).
Andra kliniska problem relaterade till hemoglobin inkluderar:
- Koldioxid- och kolmonoxidexponering: Kolmonoxid (CO) binder hemoglobin med mycket hög affinitet och bildar karboxyhemoglobin, vilket hindrar syretransport och kan vara livshotande.
- Methemoglobinemi: Oxidation av Fe2+ till Fe3+ ger methemoglobin som inte kan bära syre. Vissa läkemedel eller kemikalier kan orsaka detta; behandling kan inkludera metylénblått i utvalda fall.
- Nedbrytning: När röda blodkroppar bryts ner återvinns järn från heme, medan rester omvandlas till bilirubin som utsöndras via levern. Störningar i denna process kan ge gulsot.
Ytterligare fakta
- Varje röd blodkropp innehåller ungefär en miljard hemoglobinmolekyler, vilket gör blodet mycket effektivt för gastransport.
- Röda blodkroppar hos däggdjur saknar cellkärna och mitokondrier och förlitar sig på anaerob glykolys; en av biprodukterna från denna metabolism är 2,3‑BPG som reglerar hemoglobinets affinitet.
Sammanfattningsvis är hemoglobin ett centralt protein för syretransport och gasutbyte i kroppen. Dess struktur — fyra globinkedjor med varsin heme‑grupp — och dess allosteriska egenskaper gör det särskilt väl anpassat för att plocka upp syre i lungorna och avge det där det behövs i vävnaderna.
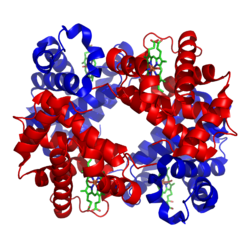
Struktur av humant hemoglobin. α- och β-underenheterna är röda och blå. De järnhaltiga hemgrupperna i grönt.
Struktur
Den vanligaste typen av hemoglobin hos däggdjur innehåller fyra sådana underenheter. Varje underenhet av hemoglobin är ett globulärt protein (globin) med en hemgrupp inuti. Varje hemgrupp har en järnatom. Denna binder en syremolekyl. Den kompletta hemoglobinmolekylen har alltså fyra globinkedjor, fyra hemmolekyler och fyra järnatomer. När hemoglobinet befinner sig i lungorna tar det upp syre i sina hemämnen och transporterar det till resten av kroppen.
Det tog flera år att utarbeta dess struktur. Max Perutz och John Kendrew utarbetade först myoglobinets struktur. Detta muskelglobin är mindre och har bara en hemgrupp.
Frågor och svar
F: Vad är hemoglobin?
S: Hemoglobin är ett protein i röda blodkroppar som innehåller järn och som används för att transportera syre runt i människokroppen.
F: Var finns hemoglobin?
S: Hemoglobin finns i de röda blodkropparna hos alla ryggradsdjur utom vitblodiga fiskar. Det förekommer också i vissa ryggradslösa djur.
F: Vad använder vissa ryggradslösa djur istället för hemoglobin?
S: Vissa ryggradslösa djur använder andra kemikalier, t.ex. hemocyanin.
F: Vilka andra gaser är hemoglobin inblandat i att transportera?
S: Hemoglobin är involverat i transporten av andra gaser än syre. Det transporterar en del av kroppens andningskoldioxid (ca 20-25% av den totala mängden).
F: Vad ger röda blodkroppar sin färg?
S: Röda blodkroppar får sin färg från hemoglobin, som är rött.
F: Hur många hemoglobinmolekyler finns det i varje röd blodkropp?
S: Det finns miljontals hemoglobinmolekyler i varje röd blodkropp.
F: Hur många röda blodkroppar finns det i människokroppen?
S: Det finns miljontals röda blodkroppar i människokroppen.
Sök