Vad är molekylvibrationer? Definition och exempel
Molekylvibrationer: definition, typer och exempel (H2, N2, O2) — hur bindningar stretchar och böjs.
Molekylära vibrationer är en av tre huvudtyper av rörelse för molekyler, tillsammans med translationsrörelse (när hela molekylen förflyttas i rymden) och rotationsrörelse (när molekylen vrider sig kring en eller flera axlar). Vibrationer innebär att bindningarna mellan atomerna i en molekyl ändrar avstånd eller vinkel relativt varandra, ofta beskrivet med en enkel fjädermodell där atomerna är ”bollar” kopplade med fjädrar.
Vad menas med en vibrationsrörelse?
En vibrationell rörelse är en periodisk förändring i position hos atomerna i en molekyl. Den enklaste typen är stretching (utsträckning/kompression) som involverar två atomer och deras bindning. Andra typer är bending (vinkeländring), torsion (vridning) och kombinerade rörelser.
Ett enkelt exempel är diatomiska molekyler som väte H2, kväve N2 och syre O2, där det finns en enda vibrationsvåg (en stretch). För flermolekylära system blir antalet möjliga vibrationsmönster fler och kan vara både symmetriska och antisymmetriska.
Hur många vibrationslägen finns?
Antalet oberoende vibrationslägen bestäms av antalet atomer N:
- För icke-linjära molekyler: 3N − 6 vibrationsgrader.
- För linjära molekyler: 3N − 5 vibrationsgrader.
Exempel: en triatomisk linjär molekyl som CO2 har 3·3−5 = 4 vibrationslägen (symmetrisk stretch, antisymmetrisk stretch och två degenerate böjningslägen). En icke-linjär triatom som H2O har 3 vibrationslägen.
Kvantiserade energier och spektroskopi
Vibrationsenergier är kvantiserade och i en första approximation kan varje vibrationsläge beskrivas som en harmonisk oscillator med energier En = hν(n + 1/2), där ν är vibrationsfrekvensen. I verkligheten förekommer anharmonicitet, vilket ger övertoner och kombinationsband samt små avvikelser från den harmoniska modellen.
Vibrationsspektrum studeras framförallt med infraröd (IR-) och Raman-spektroskopi. Viktiga urvalregler är:
- IR-aktivitet: vibration måste ge en förändring i molekylens dipolmoment.
- Raman-aktivitet: vibration måste förändra molekylens polariserbarhet.
Homonukleära diatomiska molekyler (t.ex. H2, N2, O2) är ofta IR-inaktiva eftersom de inte ändrar dipolmomentet vid stretchning, men de kan vara Raman-aktiva.
Typiska frekvensområden och tillämpningar
Vibrationsfrekvenser anges ofta i vavenheter (cm−1). Organiska bindningar finns typiskt i området ≈400–4000 cm−1 (mid-IR). Genom att analysera vilka frekvenser som absorberas eller sprids kan man identifiera funktionella grupper, bestämma molekylstrukturer och följa kemiska reaktioner — användbart inom kemi, materialvetenskap, miljöövervakning och astrokemi.
Sammanfattning
Molekylvibrationer är periodiska rörelser hos atomer i molekyler som kan beskrivas med enkla modeller (fjäder-/harmonisk oscillator) men även visar komplexa effekter (anharmonicitet, övertoner). Antalet vibrationslägen bestäms av molekylens storlek och geometri, och vibrationer är centrala i spektroskopiska metoder som IR och Raman, vilka används för att analysera och identifiera molekyler.
Typer av vibrationer
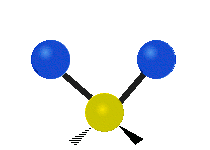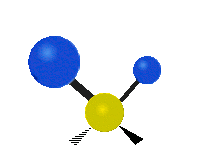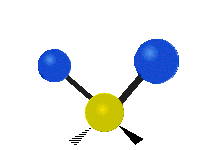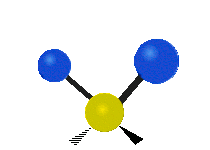
Om molekylen har fler än två atomer blir det mer komplicerat. Antag att ytterligare en atom läggs till så att det nu finns tre atomer, som i vatten H2 O där de två väteatomerna båda är knutna till den centrala syreatomen. Kom ihåg att med väte fanns det en typ av sträckning, men i vatten finns det två typer av sträckning och fyra andra typer av vibrationer som kallas böjningsvibrationer, vilket visas nedan.
Atomerna i en CH2 -grupp eller molekyler som vatten kan vibrera på sex olika sätt: symmetrisk och antisymmetrisk sträckning, saxning, gungning, vaggande och vridning:
| Symmetrisk sträckning | Antisymmetrisk sträckning | Saxning |
|
|
|
|
| Gungande | Vaggande | Vridning |
|
|
|
|
symmetrisk sträckning: när de två anslutna atomerna rör sig bort från och mot den centrala atomen samtidigt.
antisymmetrisk sträckning: När de två anslutna atomerna inte rör sig bort och mot den centrala atomen samtidigt.
saxning: Precis som namnet säger är saxning när de två atomerna rör sig bort från och mot varandra.
rockande: Här är det bara en atom som är pendeln och det finns två istället för en.
viftande: Om en person håller upp handen framför sig och sätter sina två fingrar i ett "V"-tecken och böjer handleden mot och bort från sig själv. Här är fingertopparna de anslutna atomerna och handleden är den centrala atomen.
vridning: Denna rörelse är som om en person går på ett löpband där midjan är den centrala atomen och fötterna är de två anslutna atomerna.
Molekyler med fler än tre atomer
Molekyler med fler än tre atomer är ännu mer komplicerade och har ännu fler vibrationer, som ibland kallas "vibrationslägen". Varje nytt vibrationsläge är i princip en annan kombination av de sex som visas ovan. Ju fler atomer i molekylen desto fler sätt kan de kombineras. För de flesta molekyler med N atomer är antalet möjliga vibrationer för molekylen 3N - 6, medan linjära molekyler, eller molekyler med atomerna i en rak linje, har 3N-5 vibrationer.
Relationen mellan energi och vibrationer
Newtonsk mekanik
Med hjälp av Newtons mekanik kan vibrationerna i en molekyl beräknas genom att behandla bindningarna som fjädrar. Detta är användbart eftersom en bindning, precis som en fjäder, kräver energi för att sträcka ut den och det krävs också energi för att pressa ihop den. Den energi som behövs för att sträcka ut eller klämma ihop bindningen är beroende av bindningens styvhet, som representeras av fjäderkonstanten k, och den reducerade massan, eller "masscentrum" för de två atomer som är fästade i vardera änden, som betecknas med μ. Formeln som används för att relatera den energi som krävs för att orsaka en vibration i bindningen är följande:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \over {2\pi }}{\sqrt {k \over \mu }}.\! }
h: är Plancks konstant
ν: är frekvensen och representerar den hastighet med vilken bindningen pressas ihop och dras isär igen. Ju större ν desto snabbare blir denna hastighet.
Ε: är den energi som krävs för att trycka och dra ihop bindningen.
μ: Den reducerade massan är atomernas två massor multiplicerade med varandra och dividerade med deras addition:
μ = m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \over m_{1}+m_{2}}}.\! }
Kvantmekanik
Med hjälp av kvantmekanik är formeln som beskriver fjädern exakt densamma som den Newtonska mekanikens version, förutom att endast vissa energier eller energinivåer är tillåtna. Tänk på energinivåerna som steg på en stege där en person bara kan gå upp eller ner ett steg i taget. På samma sätt som den personen inte kan stå på utrymmet mellan stegen så kan bindningen inte ha en energi mellan energinivåerna. Denna nya formel blir:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1 \over 2}\right){1 \over {2\pi }}{\sqrt {k \over m}}\! } 
där n är ett kvanttal eller en "energinivå" som kan anta värdena 0, 1, 2 ... Uttalandet att energinivåer endast kan gå upp eller ner en nivå i taget är känt som en urvalsregel som anger att de enda tillåtna övergångarna mellan energinivåer är:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
där \Delta n är energiövergången.
Tillämpningar av vibrationsrörelser
När ljus med en viss frekvens träffar en molekyl som har en vibration vars rörelse motsvarar samma frekvens absorberas ljuset av molekylen och ljusets energi får bindningarna att röra sig i den specifika vibrationsrörelsen. Genom att kontrollera om ljuset absorberas kan forskarna avgöra om det finns en viss typ av molekylär bindning och jämföra den med en lista över molekyler som har den bindningen.
Vissa molekyler som helium och argon har dock bara en atom och har inga bindningar. Detta innebär att de inte absorberar ljus på samma sätt som en molekyl med fler än en atom kan göra.
De specifika områden inom kemin som använder molekylära vibrationer i sina studier är infraröd spektroskopi (IR) och Raman-spektroskopi (Raman), där IR används i större utsträckning och har tre egna underområden. Dessa underområden är kända som nära IR-spektroskopi, mellan IR-spektroskopi och långt IR-spektroskopi. Nedan följer en allmän förteckning över dessa områden och tillämpningar i verkligheten.
Nära IR: kvantitativ bestämning av arter som proteiner, fetter, kolväten med låg molekylvikt och vatten. Ytterligare användningsområden är jordbruksprodukter, livsmedel, olja och kemisk industri.
Mid IR:Det mest populära IR-fältet används för att bestämma strukturen hos organiska och biokemiska föreningar.
Far IR: Detta område är mindre populärt, även om det har använts i oorganiska studier.
Raman: Används för kvalitativa och kvantitativa studier av oorganiska, organiska och biologiska system, ofta som en kompletterande teknik till IR.
Sök