Fenol (C6H5OH) – kemisk struktur, egenskaper och användningsområden
Fenol (C6H5OH) – upptäck dess kemiska struktur, sura egenskaper och mångsidiga användningsområden inom kemiindustrin, inklusive tvättmedel och herbicider.
Fenol är en organisk förening med formeln C6H5OH. Det är ett vitt till svagt rosa, kristallint fast ämne vid rumstemperatur med en tydlig lukt. Fenol består av en hydroxylgrupp (OH) bunden direkt till en bensenring. Den räknas ofta som en typ av alkohol, men skiljer sig kemiskt från alifatiska alkoholer eftersom den aromatiska kretsen påverkar gruppens egenskaper. Eftersom den aromatiska ringen tillsammans med hydroxylgruppen ger en stabilisering av den avprotonerade formen, påverkas dess surhet: fenol är betydligt mer sur än vanliga alkoholer. Fenol framställs huvudsakligen ur petroleum via industriprocesser. Det är en viktig molekyl i kemisk industri och används som utgångsämne vid framställning av många andra produkter, bland annat tvättmedel och herbicider.
Struktur och grundläggande data
- Molekylformel: C6H5OH
- Molekylvikt: 94,11 g/mol
- CAS-nummer: 108-95-2
- Smältpunkt: ≈ 40,5 °C
- Kokpunkt: ≈ 181,7 °C
- Täthet: ≈ 1,07 g/cm³ vid 20 °C
- Vattenlöslighet: måttlig (några gram per 100 ml vatten); blandbar med många organiska lösningsmedel
- pKa (vatten): ≈ 9,95 — betydligt surare än alifatiska alkoholer på grund av resonansstabilisering av fenoxidjonen
Kemiska egenskaper och reaktivitet
Fenol är reaktivt i flera klassiska aromatiska reaktioner:
- Elektrofil aromatisk substitutionsreaktion — OH-gruppen är orto/para-dirigerande, vilket gör reaktioner i dessa positioner särskilt lättillgängliga (t.ex. nitrering, halogenering, sulfonering).
- Bildning av fenoxider — fenol kan avprotoneras till fenoxidjoner i basiska lösningar; fenoxider är mer nukleofila och används i många synteser.
- Oxidation — fenol kan oxideras till olika produkter, bland annat kinoner vid måttlig oxidation.
- Ester- och eterbildning — fenol reagerar med acylklorider eller syror för att ge estrar och med alkylhalider (vid lämpliga förhållanden) för att ge etrar.
Framställning
I industrin produceras fenol i stor omfattning främst via cumeneprocessen: propylbensen (cumene) oxideras till cumenehydroperoxid som klyvs och ger fenol och aceton som parallellprodukt. Tidigare användes andra metoder, men cumeneprocessen dominerar på grund av ekonomiska och processmässiga fördelar.
Användningsområden
Fenol är en viktig byggsten i kemiindustrin och används bland annat till:
- Produktion av fenolformaldehydhartser (till exempel Bakelit) och andra fenolbaserade hartser.
- Syntes av bisfenol A (som används vid tillverkning av polykarbonater och epoxihartser).
- Råvara för många plaster, ytaktiva ämnen och kemikalier som används i tvättmedel och herbicider.
- Användning som desinfektions- och konserveringsmedel i vissa produkter (historiskt omnämnt som karbolsyra).
Säkerhet och miljö
Fenol är frätande och toxisk vid kontakt, inandning eller förtäring. Symptom vid exponering kan omfatta hud- och ögonirritation, kemiska brännskador, påverkan på centrala nervsystemet och systemisk toxicitet vid större exponeringar. Vid hantering bör lämplig personlig skyddsutrustning användas (handskar, skyddsglasögon, lämplig ventilation). Vid hudkontakt: spola genast med mycket vatten och sök sjukvård om det finns symptom eller vid större utsläpp.
Miljömässigt är fenol giftigt för vattenlevande organismer i högre koncentrationer, men bryts ändå ner biologiskt under aeroba förhållanden. Större utsläpp kräver därför sanering och kontroll.
Sammanfattning
Fenol (C6H5OH) är en mångsidig aromatisk förening med tydliga egenskaper som gör den mycket användbar inom kemisk industri. Dess surhet, reaktionsmönster och möjlighet att omvandlas till en rad derivat gör den till en viktig råvara för plast-, läkemedels- och ytaktivt kemiindustrin. Samtidigt kräver ämnet respektfull hantering på grund av dess frätande och toxiska natur.
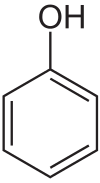
Fenolens struktur
Egenskaper
Syra
Fenol har en pKa på cirka 10. För normala alkoholer är denna siffra vanligtvis omkring 15. Fenol är dock mindre surt än föreningar som karboxylsyror. Orsaken till denna höga surhet är molekylens resonansstabilisering när den blir en anjon.
Reaktioner
Fenol kan utföra elektrofila aromatiska substitutionsreaktioner mycket bra. Detta beror på att det ensamma paret på syreatomen kan ge elektroner genom bensenringen till en elektrofil. Eftersom det ensamma paret har så hög energi reagerar fenol ibland för många gånger.
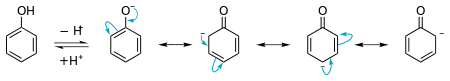
Ett diagram som visar stabiliseringen av det ensamma paret på syret i fenol. Detta förklarar surheten.
Historia
Fenol upptäcktes för första gången 1834. Den hittades som en produkt från kolförbränning. Ett av de första användningsområdena var att döda bakterier vid kirurgi. Den används fortfarande i vissa smärtstillande medel. Under andra världskriget användes fenol även av nazisterna. De använde det i koncentrationsläger för att snabbt döda små grupper av människor.
Sök