Atomteori: Atomens struktur, historia och grundläggande principer
Atomteori: Lär dig atomens struktur, historia och grundprinciper — protoner, neutroner, elektroner och moderna idéer från Demokritos till Dalton.
Inom kemi och fysik förklarar atomteorin hur vår förståelse av atomen har förändrats med tiden. En gång trodde man att atomer var de minsta bitarna av materia. Nu vet man dock att atomer består av protoner, neutroner och elektroner. Dessa subatomära partiklar består av kvarkar. Den första idén om atomen kom från den grekiske filosofen Demokritos. Många av idéerna i den moderna teorin kom från John Dalton, en brittisk kemist och fysiker.
Teorin gäller för fasta ämnen, vätskor och gaser, men inte på samma sätt som för plasmor eller neutronstjärnor.
Kort historik och viktiga modeller
- Demokritos (ca 400 f.Kr.) - föreslog att materia består av odelbara byggstenar, "atomos".
- John Dalton (början av 1800‑t) - återintroducerade idén om atomer som små, oföränderliga partiklar med olika massor.
- J.J. Thomson (1897) - upptäckte elektronen med katodstråleexperiment och föreslog "plumpudding"-modellen där elektroner är inbäddade i en positiv massa.
- Ernest Rutherford (1911) - visade genom guldfolieexperimentet att atomen har en liten, tät och positivt laddad kärna.
- Niels Bohr (1913) - införde kvantiserade banor för elektroner som förklarade linjespektrum hos väte.
- Kvantmekanisk modell (1920‑t och framåt) - ersatte klassiska banor med elektronmoln och vågfunktioner (Schrödinger, Heisenberg), vilket ger sannolikhetsfördelningar för var elektroner kan finnas.
Atomens uppbyggnad
En atom består av en kärna i centrum, sammansatt av protoner (positiv laddning) och neutroner (elektriskt neutrala). Runt kärnan finns ett elektronmoln med negativt laddade elektroner. Storleksordningen för en atom är ungefär 10−10 meter (ångström), medan kärnans diameter är cirka 10−15–10−14 meter.
Några viktiga begrepp:
- Atomnummer (Z) – antal protoner i kärnan; bestämmer grundämnet.
- Masstal (A) – summa av protoner och neutroner i kärnan.
- Isotoper – atomer av samma element (samma Z) men med olika antal neutroner (olika A).
- Jon – en atom eller molekyl som har förlorat eller tagit upp elektroner och därmed har en nettoladdning.
Elektroner, orbitaler och kemiska egenskaper
Elektronerna befinner sig inte i välbestämda banor som i klassisk fysik, utan i orbitaler som beskrivs av vågfunktioner. Orbitalerna (s, p, d, f) har olika form och energi. Antalet och fördelningen av valenselektroner (de ytligaste elektronerna) avgör i hög grad atomens kemiska egenskaper och hur den binder till andra atomer.
Grundläggande principer som styr elektronernas uppförande:
- Paulis uteslutningsprincip – två elektroner i samma atom kan inte ha samma uppsättning kvanttal.
- Aufbau-principen – elektroner fyller orbitaler med lägst energi först.
- Hunds regel – inom en subtilldelning fylls orbitalerna med enkel elektronspinn innan parning sker.
Kärninteraktioner och radioaktivitet
Kärnan hålls ihop av den starka kärnkraften, som verkar mellan kvarkarna via gluoner och ansvarar för bindningen mellan protoner och neutroner. Det finns även svaga växelverkningar som medverkar i vissa typer av radioaktivt sönderfall (t.ex. beta‑sönderfall).
Typer av radioaktivt sönderfall:
- Alfasönderfall – avges heliumkärnor (2 protoner + 2 neutroner).
- Betasönderfall – omvandling mellan proton och neutron via svag växelverkan, med utsläpp av elektroner eller positroner och neutriner.
- Gammastrålning – högenergetisk fotonstrålning från exciterade atomkärnor.
Subatomära partiklar och kvarkar
Protoner och neutroner är inte elementära utan byggs upp av kvarkar (huvudsakligen upp‑ och nedkvarkar) och hålls samman av gluoner. Elektronen betraktas däremot som en elementarpartikel i standardmodellen. Utöver dessa finns även andra kvarkar, leptoner och bärarbosoner som beskrivs av partikelfysiken.
Viktig experimentell evidens
- Kathodstråleexperiment – ledde till elektrons upptäckt.
- Guldfolieexperiment (Rutherford) – visade att massan och positiva laddningen är koncentrerad i en liten kärna.
- Spektroskopi – analys av ljus från atomer gav insikt i kvantiserade energinivåer.
- Partikelacceleratorer och detektorer – bekräftar detaljer om subatomära partiklar och deras växelverkningar.
Tillämpningar och begränsningar
Kunskap om atomer ligger till grund för kemin, materialvetenskap, elektronik, medicinsk diagnostik (t.ex. röntgen, PET), kärnenergi och många tekniker som halvledare och nanoteknik. Atomteorin beskriver väl egenskaper hos fasta ämnen, vätskor och gaser under vanliga förhållanden.
Begränsningar: i extremt heta och täta tillstånd, som i plasma eller i neutronstjärnor, förändras beteenden — fria kärnor, fria elektroner eller degenererade neutroner dominerar och enklare atommodeller gäller inte längre utan måste ersättas av plasmafysik eller kärn- och partikelfysik.
Sammanfattning av nyckelbegrepp
- Atomen: består av kärna (protoner + neutroner) och elektroner.
- Atomnummer bestämmer grundämnet, masstal bestämmer isotopen.
- Elektronernas fördelning avgör kemiska egenskaper.
- Moderna atommodeller bygger på kvantmekanik och sannolikhetsmoln (orbitaler).
- Protoner och neutroner består i sin tur av kvarkar och växelverkar via gluoner.
Atomteorin är en central del av naturvetenskapen och har utvecklats genom experimentell upptäckt och teoretisk utveckling. Den fortsätter att fördjupas när vi studerar materia vid ännu mindre skalor och i extrema miljöer.

Demokrit var en grekisk filosof, 460 f.Kr.

Roger Joseph Boscovich. En kroatisk jesuit som tillhandahöll en prototyp av atomteorin.

John Dalton (1766-1844), engelsk kemist och fysiker.
Sir Joseph John Thomson (1856-1940), engelsk fysiker, upptäckte elektronen och dess negativa laddning. Han fick Nobelpriset i fysik.
Demokritos atomteori
Demokrit trodde att om man skär något på mitten om och om igen så måste man till slut sluta. Han sade att den sista biten materia inte kunde skäras mindre. Demokrit kallade dessa små materiebitar för atomer, vilket betyder "odelbara". Han trodde att atomerna skulle vara för evigt, aldrig förändras och inte kunna förstöras. Demokrit trodde att det inte fanns något mellan atomerna och att allt omkring oss kunde förklaras om vi kunde förstå hur atomerna fungerade.
Vissa andra filosofer höll med och andra var oense. De hade inget sätt att experimentera för att visa om hans teori var sann eller inte.
Boscovichs atomteori
År 1758 beskrev Roger Joseph Boscovich en föregångare till atomteorin.
Daltons atomteori
År 1803 omarbetade den engelske vetenskapsmannen John Dalton, född i Cumberland, Demokrits teori på följande sätt:
- All materia består av atomer.
- Att atomer är odelbara och osynliga partiklar.
- Att atomer av samma grundämne har samma typ och massa.
- De atomer som ingår i kemiska föreningar finns i bestämda proportioner.
- Kemiska förändringar motsvarar en omorganisation av de atomer som deltar i den kemiska reaktionen.
Dalton definierade atomen som den grundläggande enheten i ett grundämne som kan delta i en kemisk kombination.
Thomsons atommodell
1850 konstruerade Sir William Crookes ett "urladdningsrör", dvs. ett glasrör utan luft och med metallelektroder i ändarna, som kopplades till en högspänningskälla. När man skapar ett vakuum i röret kan man se en ljus urladdning som går från katoden (negativt laddad elektrod) till anoden (positivt laddad elektrod). Crookes gav emissionen namnet "katodstrålar".
Efter katodstråleexperimenten fastställde Sir Joseph John Thomson att den utsända strålen bildades av negativa laddningar, eftersom de attraherades av den positiva polen. Thomson visste att atomerna var elektriskt neutrala, men han konstaterade att en atom måste ha samma mängd negativa och positiva laddningar för att detta ska inträffa. De negativa laddningarna fick namnet elektroner (e-).
Enligt de antaganden som gjorts om atomernas neutrala laddning föreslog Thomson den första atommodellen, som beskrevs som en positivt laddad sfär i vilken elektronerna var inlagda (med negativa laddningar). Den är känd som plumpuddingmodellen.
År 1906 fastställde Robert Millikan att elektronerna hade en Coulomb-laddning (C) på -1,6 * 10−19, vilket gjorde det möjligt att beräkna dess massa som liten, motsvarande 9,109 * 10−31 kg.
Samtidigt kunde Eugene Goldstein 1886 genom experiment med katodurladdningsrör fastställa att de positiva laddningarna hade en massa på 1,6726 * 10−27 kg och en elektrisk laddning på +1,6 * 10 C−19. Lord Ernest Rutherford gav senare dessa positivt laddade partiklar namnet protoner.

Schematisk bild av Thomson-modellen.
Rutherfords atommodell
År 1910 lade den nyzeeländske fysikern Ernest Rutherford fram idén att de positiva laddningarna i atomen huvudsakligen finns i atomens centrum, i kärnan, och elektronerna (e-) runtomkring den.
Rutherford visade detta när han använde en alfastrålningskälla (från helium) för att träffa de mycket tunna guldplåtarna, som var omgivna av en lampskärm av zinksulfid som gav synligt ljus när de träffades av alfastrålning. Experimentet kallades Geiger-Marsden-experimentet eller guldfolieexperimentet.
Vid det här laget var atomens viktigaste beståndsdelar klara, plus upptäckten att atomer av ett grundämne kan förekomma i isotoper. Isotoper varierar i antalet neutroner i kärnan. Även om denna modell var välförståelig har den moderna fysiken utvecklats ytterligare, och dagens idéer kan inte göras lätta att förstå. Några idéer om dagens atomfysik finns i länkarna i tabellen nedan.
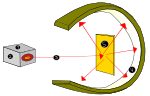
Atomexperiment av Lord Ernest Rutherford
Modern fysik
Atomer är inte elementarpartiklar, eftersom de består av subatomära partiklar som protoner och neutroner. Protoner och neutroner är inte heller elementarpartiklar eftersom de består av ännu mindre partiklar, så kallade kvarkar, som är sammanfogade av andra partiklar som kallas gluoner (eftersom de "limmar" ihop kvarkarna i atomen). Kvarkar är elementära eftersom kvarkar inte kan delas upp ytterligare.
Frågor och svar
F: Vad är atomteorin?
S: Atomteorin förklarar hur vår förståelse av atomen har förändrats med tiden.
F: Vad trodde man en gång i tiden att atomer var?
S: En gång trodde man att atomer var de minsta bitarna av materia.
F: Vad består atomer egentligen av?
S: Atomer består av protoner, neutroner och elektroner.
F: Vad består subatomära partiklar av?
Svar: Subatomära partiklar består av kvarkar.
F: Vem är den grekiska filosof som först kom med idén om atomen?
S: Den första idén om atomen kom från den grekiske filosofen Demokrit.
F: Vem är den brittiska kemist och fysiker som bidrog med många idéer till den moderna teorin?
S: John Dalton, en brittisk kemist och fysiker, bidrog med många idéer till den moderna teorin.
F: Gäller atomteorin för plasmor eller neutronstjärnor?
S: Teorin gäller för fasta ämnen, vätskor och gaser, men den gäller inte på ett sätt som är analogt med plasma eller neutronstjärnor.
Sök