SN2-reaktion
SN 2-reaktionen (även kallad bimolekylär nukleofil substitution) är en substitutionsreaktion inom organisk kemi. Det är en typ av nukleofil substitution, där ett ensam par från en nukleofil angriper ett elektronbristande elektrofilcentrum och binder sig till det. Därmed utvisas en annan grupp som kallas "avgångsgrupp". Den inkommande gruppen ersätter alltså den avgående gruppen i ett steg. Eftersom två reagerande arter är inblandade i det långsamma, hastighetsbestämmande steget i reaktionen, leder detta till namnet bimolekylär nukleofil substitution, eller SN 2. Bland oorganiska kemister kallas SN 2-reaktionen ofta för utbytesmekanismen.
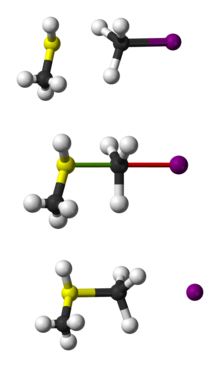
Representation av SN 2-reaktionen mellan CH3 SH och CH3 I med boll och pinne.
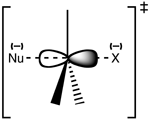
Strukturen för övergångstillståndet SN 2
Reaktionsmekanism
Reaktionen sker oftast vid ett alifatiskt kolcentrum sp med en 3elektronegativ, stabil avgångsgrupp knuten till det - "X" - ofta en halogenidatom. Brytningen av C-X-bindningen och bildandet av den nya C-Nu-bindningen sker samtidigt för att bilda ett övergångstillstånd där kolet under nukleofil angrepp är pentakoordinerat och ungefär sp2 hybridiserat. Nukleofilen angriper kolet i 180° till den avgående gruppen, eftersom detta ger den bästa överlappningen mellan nukleofilens ensamma par och C-X σ* antibonding orbital. Den avgående gruppen trycks sedan bort från den motsatta sidan och produkten bildas.
Om substratet som utsätts för nukleofil angrepp är chiralt kan detta leda till en inversion av stereokemin, som kallas Walden-inversion, även om det inte nödvändigtvis är så.
I ett exempel på SN 2-reaktionen ger attacken av OH −(nukleofilen) på en brometan (elektrofilen) etanol, med bromid som avgångsgrupp:
En SN 2-reaktion inträffar om angreppsvägen på baksidan inte blockeras av andra atomer i molekylen (steriskt hindrad av substituenter på substratet). Så denna mekanism uppträder vanligtvis vid ett ohindrat primärt kolcentrum. Om det finns sterisk trängsel på substratet nära den avgående gruppen, t.ex. vid ett tertiärt kolcentrum, kommer substitutionen att använda en S N1-mekanism snarare än en SN 2-mekanism, (en SN 1-mekanism skulle också vara mer sannolik med blockerade molekyler eftersom en tillräckligt stabil karbokationsintermediär skulle kunna bildas).
I samordningskemi sker associativ substitution genom en liknande mekanism som SN 2.
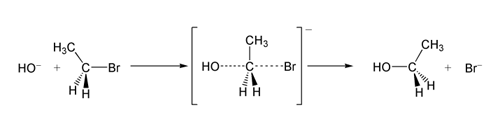
SN 2 reaktion av brometan med hydroxidjoner.
Faktorer som påverkar reaktionshastigheten
Fyra faktorer påverkar reaktionshastigheten:
- Underlag. Substratet spelar den viktigaste rollen när det gäller att bestämma reaktionshastigheten. Detta beror på att nukleofilen angriper från baksidan av substratet, vilket bryter den kolförenande gruppbindningen och bildar kol-nukleofilbindningen. För att maximera hastigheten för SN 2-reaktionen måste substratets baksida vara så obehindrad som möjligt. Sammantaget innebär detta att metyl- och primära substrat reagerar snabbast, följt av sekundära substrat. Tertiära substrat deltar inte i SN 2-reaktioner på grund av steriskt hinder.
- Nukleofil. Liksom substratet påverkar steriskt hinder nukleofilens styrka. Metoxidanjonen är till exempel både en stark bas och nukleofil eftersom den är en metylnukleofil och därmed är mycket obehindrad. Tert-butoxid däremot är en stark bas, men en dålig nukleofil, eftersom dess tre metylgrupper hindrar dess närmande till kolet. Nukleofilstyrkan påverkas också av laddning och elektronegativitet: nukleofiliteten ökar med ökande negativ laddning och minskande elektronegativitet. Till exempel är OH- en bättre nukleofil än vatten, och I- är en bättre nukleofil än Br- (i polära protiska lösningsmedel). I ett polärt aprotiskt lösningsmedel ökar nukleofiliteten en kolumn uppåt i det periodiska systemet eftersom det inte finns någon vätebindning mellan lösningsmedlet och nukleofilen. I detta fall speglar nukleofiliteten basiskheten. I- skulle därför vara en svagare nukleofil än Br- eftersom det är en svagare bas.
- Lösningsmedel. Lösningsmedlet påverkar reaktionshastigheten eftersom lösningsmedel kan omge en nukleofil eller inte och därmed hindra eller inte hindra den från att närma sig kolatomen. Polära aprotiska lösningsmedel, som tetrahydrofuran, är bättre lösningsmedel för denna reaktion än polära protiska lösningsmedel, eftersom polära protiska lösningsmedel kommer att lösas upp av lösningsmedlets vätebindning till nukleofilen. Detta hindrar den från att angripa kolet med avgångsgruppen.
- Lämnar gruppen. Den avgående gruppen påverkar reaktionshastigheten. Ju stabilare avgångsgruppen är, desto större är sannolikheten att den tar med sig de två elektronerna i kolets avgångsgruppsbindning när nukleofilen angriper kolet. Ju svagare den avgående gruppen är som konjugerad bas, desto bättre är den avgående gruppen. På samma sätt gäller att ju starkare dess motsvarande syra är, desto bättre är den avgående gruppen. Exempel på bra avgångsgrupper är halogenider (utom fluorid) och tosylat. Men HO- och H2 N- är inte bra avgångsgrupper.
Reaktionskinetik
Hastigheten för en SN 2-reaktion är av andra ordningen, eftersom det hastighetsbestämmande steget beror på koncentrationen av nukleofilen [Nu− ] och koncentrationen av substratet [RX].
r = k[RX][Nu− ]
Detta är en viktig skillnad mellan mekanismerna SN 1 och SN 2. I SN 1-reaktionen angriper nukleofilen efter att det hastighetsbegränsande steget är över. Men i en SN 2-reaktion tvingar nukleofilen bort avgångsgruppen i det begränsande steget. Med andra ord beror SN 1-reaktionens hastighet endast på substratets koncentration, medan SN 2-reaktionens hastighet beror på koncentrationen av både substratet och nukleofilen. I de fall då båda mekanismerna är möjliga (t.ex. vid ett sekundärt kolcentrum) beror mekanismen på lösningsmedel, temperatur, koncentrationen av nukleofilen eller av den avgående gruppen.
SN 2-reaktioner gynnas i allmänhet i primära alkylhalogenider eller sekundära alkylhalogenider med ett aprotiskt lösningsmedel. De inträffar med försumbar hastighet i tertiära alkylhalogenider på grund av steriskt hinder.
SN 2 och SN 1 är två ytterligheter på en glidande skala av reaktioner. Det är möjligt att hitta många reaktioner som uppvisar både SN 2 och SN 1 i sina mekanismer. Det är till exempel möjligt att få ett kontaktjonpar som bildas från en alkylhalogenid där jonerna inte är helt separerade. När dessa genomgår substitution kommer stereokemin att vara inverterad (som i SN 2) för många av de reagerande molekylerna, men några få kan uppvisa bibehållen konfiguration. SN 2-reaktioner är vanligare än SN 1-reaktioner.
E2 konkurrens
En vanlig sidoreaktion som äger rum vid SN 2-reaktioner är E2-eliminering: den inkommande anjonen kan agera som en bas snarare än som nukleofil, avlägsna en proton och leda till att alken bildas. Denna effekt kan demonstreras i gasfasreaktionen mellan en sulfonat och en enkel alkylbromid som äger rum i en masspektrometer:

Med etylbromid är reaktionsprodukten huvudsakligen substitutionsprodukten. När det steriska hindret runt det elektrofila centret ökar, som med isobutylbromid, är substitutionen missgynnad och eliminering är den dominerande reaktionen. Andra faktorer som gynnar eliminering är basens styrka. Med det mindre basiska bensoatsubstratet reagerar isopropylbromid med 55 % substitution. I allmänhet följer gasfasreaktioner och reaktioner i lösningsfas av denna typ samma tendenser, även om lösningsmedelseffekterna i den första faller bort.
Mekanism för rondeller
En utveckling som uppmärksammades under 2008 gäller en SN 2 rundgångsmekanism som observerats i en gasfasreaktion mellan kloridjoner och metyljodid med en speciell teknik som kallas crossed molecular beam imaging. När kloridjonerna har tillräcklig hastighet är energin hos de resulterande jodidjonerna efter kollisionen mycket lägre än förväntat, och man har antagit att energi går förlorad som ett resultat av en fullständig rundgång av metylgruppen runt jodatomen innan den faktiska förskjutningen äger rum.
Relaterade sidor
- Substitutionsreaktion
- SN 1 reaktion
Frågor och svar
Fråga: Vad är SN2-reaktionen?
S: SN2-reaktionen är en substitutionsreaktion inom organisk kemi, där en nukleofil attackerar ett elektrofilt centrum med elektronbrist, driver ut en lämnande grupp och sedan ersätter den i ett steg.
F: Vilken typ av substitutionsreaktion är SN2-reaktionen?
S: SN2-reaktionen är en typ av nukleofil substitutionsreaktion.
F: Hur många reagerande ämnen är inblandade i det långsamma, hastighetsbestämmande steget i SN2-reaktionen?
S: Två reagerande arter är inblandade i det långsamma, hastighetsbestämmande steget i SN2-reaktionen.
F: Vad betyder namnet "bimolekylär nukleofil substitution" för SN2-reaktionen?
S: Namnet "bimolekylär nukleofil substitution" för SN2-reaktionen syftar på det faktum att två reagerande arter är inblandade i det långsamma, hastighetsbestämmande steget i reaktionen.
F: Vad är en nukleofil i samband med SN2-reaktionen?
S: En nukleofil är en molekyl eller jon som donerar ett ensamt elektronpar för att bilda en kemisk bindning.
F: Vad är en elektrofil i samband med SN2-reaktionen?
S: En elektrofil är en molekyl eller jon som accepterar ett par elektroner för att bilda en kemisk bindning.
F: Vad är SN2-reaktionen ofta känd som bland oorganiska kemister?
S: Bland oorganiska kemister är SN2-reaktionen ofta känd som utbytesmekanismen.
Sök