Bensen
Bensen, även känd som bensol, är en organisk kemisk förening med formeln 6CH6. Det är en färglös och brännbar vätska med en söt lukt. Bensenmolekylerna är en ring av sex kolatomer som var och en är bunden till en väteatom. Det är en aromatisk förening, vilket innebär att ringen har omväxlande dubbelbindningar.
Bensen är cancerframkallande, vilket innebär att den kan orsaka cancer. Det har många användningsområden i verkligheten. Den används som tillsats i bensin, plast, syntetiskt gummi, färgämnen och är ett industriellt lösningsmedel, vilket innebär att den kan lösa upp många andra kemiska molekyler. Bensen är också en naturlig del av råolja och förekommer därför i bensin. Många läkemedel innehåller delar som är tillverkade av bensen.
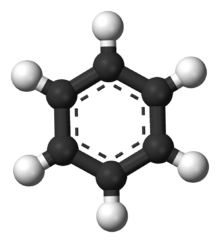
Modell av en bensenmolekyl. Kolatomer visas som svarta och väte som vita.
_1964,_MiNr_440.jpg)
1964 gav det tyska postverket ut ett frimärke för att fira 100 år efter upptäckten av bensen.
Struktur
Bensen har särskilda egenskaper som kallas aromaticitet. Alla sex kolatomer i ringen befinner sig på samma plana plan. För att förklara alla bindningar i en sexkolig ring måste det finnas alternerande dubbla kolbindningar (konjugerat system):
Om bensen hade tre dubbelbindningar skulle tre sidor av ringen vara kortare än de andra tre sidorna. Röntgendiffraktion visar att alla sex kol-kol-bindningar i bensen är lika långa, 140 picometer (pm). Längden på C-C-bindningarna är större än en dubbelbindning (135 pm) men kortare än en enkelbindning (147 pm). Detta mellanliggande avstånd är förenligt med elektrondelokalisering: elektronerna för C-C-bindning fördelas lika mellan var och en av de sex kolatomerna. Molekylen är planär. En representation är att strukturen existerar som en överlagring av så kallade resonansstrukturer, snarare än någon av formerna individuellt. (Med andra ord växlar molekylens dubbelbindningar snabbt mellan par av kolatomer). Elektronernas delokalisering är en förklaring till den termodynamiska stabiliteten hos bensen och besläktade aromatiska föreningar. Det är troligt att denna stabilitet bidrar till de märkliga molekylära och kemiska egenskaper som kallas aromaticitet. För att indikera bindningarnas delokaliserade karaktär avbildas bensen ofta med en cirkel inuti ett hexagonalt arrangemang av kolatomer.
Som vanligt i organisk kemi har kolatomerna i diagrammet ovan inte märkts. Eftersom varje kolatom har 2p-elektroner, donerar varje kolatom en elektron till den delokaliserade ringen ovanför och nedanför bensenringen. Det är överlappningen av p-orbitalerna både ovanför och under ringen som ger upphov till pi-molnen.
År 1986 ifrågasatte några kemister den delokaliserade synen på bensen i en artikel som publicerades i tidskriften Nature. De visade att elektronerna i bensen nästan säkert är lokaliserade till vissa kolatomer. De visade att bensenens aromatiska egenskaper kommer från spinkoppling snarare än elektrondelokalisering. Andra forskare skrev artiklar som stödde denna uppfattning i Nature 1987. Men kemister är långsamma med att övergå från synen på delokaliserade elektroner.
Derivat av bensen förekommer tillräckligt ofta som en komponent i organiska molekyler för att det finns en Unicode-symbol i blocket Miscellaneous Technical med koden U+232C (⌬) för att representera bensen med tre dubbelbindningar, och U+23E3 (⏣) för en delokaliserad version.
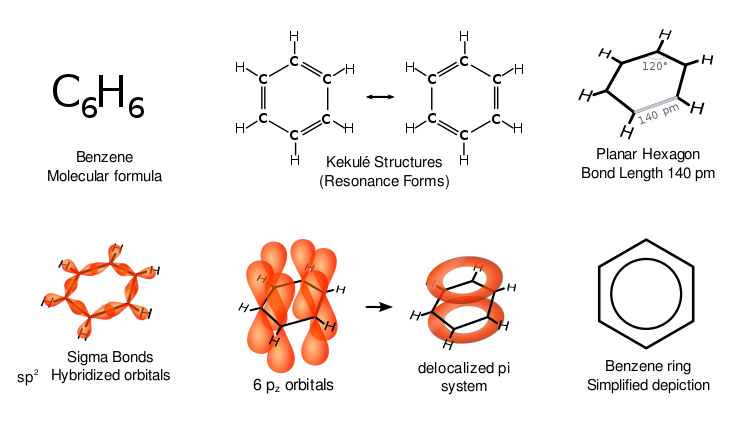
De olika framställningarna av bensen
Frågor och svar
F: Vad är bensen?
A: Bensen är en organisk kemisk förening.
F: Vad är den kemiska formeln för bensen?
S: Den kemiska formeln för bensen är C6H6.
F: Hur ser bensen ut och hur luktar den?
S: Bensen är en färglös och brännbar vätska med en söt lukt.
F: Hur är en bensenmolekyl uppbyggd?
Svar: En bensenmolekyl är en ring av sex kolatomer som var och en är bunden till en väteatom. Det är en aromatisk förening, vilket innebär att ringen har omväxlande dubbelbindningar.
F: Är bensen cancerframkallande?
S: Ja, bensen är cancerframkallande, vilket innebär att den kan orsaka cancer.
F: Vilka användningsområden för bensen finns i verkligheten?
S: Bensen används som tillsats i bensin, plast, syntetiskt gummi, färgämnen och är ett industriellt lösningsmedel, vilket innebär att det kan lösa upp många andra kemiska molekyler. Många läkemedel innehåller också delar som är tillverkade av bensen.
F: Var finns bensen?
S: Bensen är en naturlig del av råolja och finns därför i bensin.
Sök