Cheletropisk reaktion – definition, mekanism och exempel
Upptäck cheletropiska reaktioner: definition, mekanism, exempel och betydelsen av cheletropa extrusioner som frigör gas och driver reaktionen.
En cheletropisk reaktion är en speciell typ av pericyklisk reaktion där en enda atom i en av reaktanter bildar två nya bindningar samtidigt. Pericykliska reaktioner går via ett övergångstillstånd med en cyklisk uppradning av atomer och överlappande orbitaler, där σ‑ och π‑bindningar omorganiseras i denna cykliska enhet.
Mekanism och egenskaper
Cheletropiska reaktioner är i regel koncertanta (sker i ett stegs mekanism) och involverar en cyklisk övergångstillstånd där båda nya bindningarna bildas eller bryts vid samma atom. Det gör att reaktionen ofta är stereospecifik och styrs av orbitalsymmetrin i övergångstillståndet. En viktig teoretisk ram för att förutsäga om en given cheletropisk process är termiskt tillåten är Woodward–Hoffmann-reglerna (konservering av orbitalsymmetri): beroende på antal involverade elektronpar och hur bindningar bildas kan reaktionen vara suprafacial eller antarafacial.
Skillnad mot andra cycloadditioner
Cheletropiska reaktioner är en underklass av cycloadditioner. Det som särskiljer dem är att båda de nya bindningarna till en av reaktanter görs till samma atom (till exempel en karben‑ eller heteroatom). I många vanliga cycloadditioner binds varje av de två nya σ‑bindningarna till olika atomer på reaktanten, medan cheletropiska reaktioner koncentrerar båda bindningarna till en och samma atom.
Exempel
- Cyclopropanering med karbener: Addition av en karben (t.ex. :CH2) till en dubbelbindning är ett klassiskt exempel. Karbenkolet bildar samtidigt två nya σ‑bindningar till de två kolatomerna i alkenet, och produkten blir en cyklopropanring. Detta är en cheletropisk addition eftersom den ena reaktantens (karbenets) single atom får två nya bindningar.
- Cheletropa extrusioner: I vissa retro‑cheletropiska reaktioner frigörs en liten, ofta gasformig molekyl. Exempel är termisk avspjälkning av svaveloxid från sulfolener (ger butadien + SO2) eller andra system där utsläpp av CO eller N2 förekommer. I dessa fall är drivkraften ofta både entalpisk (stabil produkt) och entropisk (frigörelse av en gas), vilket skiftar jämvikten mot produkterna.
- Metallkomplexreaktioner: Vissa reaktioner där en liten ligand (t.ex. CO) avspjälkas eller binds till en metall kan beskrivas i cheletropiska termer när två bindningar bildas eller bryts gentemot samma atom/fragment i ett concerted steg.
Drivkrafter och termodynamik
De viktigaste faktorerna som bestämmer om en cheletropisk reaktion sker är: förändring i bindningsenergi (ΔH), förändring i ordning/antal partiklar (ΔS) och orbitalövergångarnas symmetri. Extrusioner där en gas som CO eller N2 frigörs gynnas ofta starkt av den positiva entropiförändringen. I andra fall kan ringstrain, bildning av aromatiska eller stabila produkter samt elektroniska effekter (elektronfattiga eller -rika centra) vara avgörande.
Stereokemi och experimentell bevisning
Cheletropiska reaktioner är ofta stereospecifika: suprafacial addition till en dubbelbindning leder till retention av konfiguration hos π‑systemet, medan olika topologier i övergångstillståndet kan ge andra utfall. Experimentellt studeras mekanismen med kinetik, isotopmärkning, stereokemiska studier och modernare metoder som beräkningskemi (övergångstillståndsberäkningar) och spektralanalys för att avgöra om reaktionen är concerted eller proceeds via intermediärer.
Sammanfattning
En cheletropisk reaktion är en pericyklisk, ofta concerted omorganisation där en enda atom i en reaktant bildar eller förlorar två bindningar i ett cykliskt övergångstillstånd. De är en viktig undergrupp av cycloadditioner och retro‑cheletropiska extrusioner, och studeras både för sin teoretiska betydelse (orbitalsymmetri, stereokemi) och sina praktiska tillämpningar (t.ex. syntes av cyklopropaner eller termisk eliminering av små gaser).
I figur 1 till höger visas några typiska exempel. I ett av exemplen avges en kolatom som blir kolmonoxid (CO) — i sådana fall talar man ofta om en cheletropisk extrusion där frigörelsen av en gas är en viktig drivkraft. De två första exemplen i figuren är kända som "cheletropa extrusioner" eftersom en liten stabil molekyl avges vid reaktionen.

Figur 1. Percykliska reaktioner
Teoretisk analys
På grund av geometrin hos de molekyler som är inblandade i cheletropa reaktioner bekräftar de ett antal förutsägelser som gjorts av teoretiska kemister. Cheletropiska reaktioner bekräftar bevarandet av symmetrin i molekylorbitalerna.
I det pericykliska övergångstillståndet donerar en liten molekyl två elektroner till ringen. Två möjliga geometrier kan förklara reaktionen. Den lilla molekylen kan närma sig antingen linjärt eller icke-linjärt. I den linjära närmandet pekar elektronerna i den lilla molekylens orbitum direkt mot π-systemet i den stora molekylen. I den icke-linjära metoden närmar sig orbitalet i en något förskjuten vinkel. π-systemets förmåga att rotera när den lilla molekylen närmar sig är avgörande för att bilda nya bindningar. Rotationsriktningen kommer att vara olika beroende på hur många π-elektroner som finns i systemet. Nedan visas ett diagram över ett fragment med två elektroner som närmar sig ett π-system med fyra elektroner med hjälp av molekylära orbitaler i gränszonen. Rotationen kommer att vara disrotatorisk om den lilla molekylen närmar sig linjärt och konrotatorisk om molekylen närmar sig icke-linjärt. Disrotatorisk och konrotatorisk anger hur bindningarna i π-systemet roterar. Disrotatoriskt betyder motsatt riktning medan konrotatoriskt betyder samma riktning. Detta visas också i diagrammet nedan.
Med hjälp av Huckels regel kan man avgöra om π-systemet är aromatiskt eller antiaromatiskt. Om det är aromatiskt, använder linjära metoder en disrotatorisk rörelse, medan icke-linjära metoder använder en konrotatorisk rörelse. Motsatsen gäller för ett antiaromatiskt system. Linjära tillvägagångssätt kommer att ha konrotatorisk rörelse medan icke-linjära tillvägagångssätt kommer att ha disrotatorisk rörelse.
Cheletropa reaktioner som involverar SO2
Termodynamik
När svaveldioxid reagerar med butadien och isopren uppstår två olika produkter. Reaktionsmekanismen styr vad som skapas. Både en kinetisk produkt och en termodynamisk produkt är möjliga. Mer av den termodynamiska produkten bildas än den kinetiska produkten. Den kinetiska produkten kommer från en Diels-Alder-reaktion, medan en cheletropisk reaktion ger en mer termodynamiskt stabil produkt. Den cheletropa vägen används mer eftersom den ger en stabilare addukt med femledad ring. I schemat nedan visas skillnaden mellan de två produkterna. Vägen till vänster visar den termodynamiska produkten, medan vägen till höger visar den kinetiska produkten. Suarez och Sordo visade detta 1995. De visade detta både med experiment och med hjälp av Gaussiska beräkningar.
Kinetik
Ett exempel på detta är de cheletropa reaktionerna av 1,3-diener med svaveldioxid. Kemister har noggrant undersökt kinetiken för denna reaktion. År 1976 mätte Isaacs och Laila de kenetiska faktorerna för addition av svaveldioxid till butadienderivat. Additionshastigheten övervakades i bensen vid 30 °C med ett inledande tjugofaldigt överskott av dien. De använde en spektrofotometer för att studera ljuset vid 320 nm för att mäta SO2 . Reaktionen uppvisade "pseudo första ordningens kinetik". Kemisterna upptäckte att elektronåterkallande grupper på dienet minskade reaktionshastigheten. Reaktionshastigheten påverkades också avsevärt av steriska effekter av 2-substituenter, där mer skrymmande grupper ökade reaktionshastigheten. (Med andra ord, ju större grupp av atomer som hängde från den andra kolatomen, desto snabbare gick reaktionen). Författarna tillskriver detta tendensen hos skrymmande grupper att gynna den cisoida konformationen hos dienen som är väsentlig för reaktionen (se tabellen nedan). Dessutom mättes hastigheterna vid fyra temperaturer för sju av dienerna. Utifrån dessa mätningar använde kemisterna Arrheniusekvationen för att beräkna aktiveringsenthalpin (ΔH‡ ) och aktiveringsentropin (ΔS‡ ) för varje reaktion. Detta var ett av de första viktiga försöken att studera kenetiken hos en cheletropisk reaktion.
| -Butadien | 104 k /min−1 (30 °C) (± 1-2 %) absolut | 104 k /min−1 (30 °C) (± 1-2 %) relativ | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-metyl | 1.83 | 1.00 | 14.9 | -15 |
| 2-etyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoetyl | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyl | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenyl) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetyl | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metyl | 0.18 | 0.10 | N/A | N/A |
| trans-1-metyl | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetylen-cyklohexan. | 24.7 | 13.5 | 11.4 | -16 |
| 2-metyl-1,1,4,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel och Sordo mätte 2002 kinetiken för addition av svaveldioxid till 1,2-dimetylidencyklokalkaner. De skrev att reaktionen av 1,2-dimetylidencyklohexan med svaveldioxid kan ge två olika produkter beroende på reaktionsförhållandena. Reaktionen ger motsvarande sultin genom en hetero-Diels-Alder-reaktion under kinetisk kontroll (≤ -60 °C), men under termodynamisk kontroll (≥ -40 °C) ger reaktionen motsvarande sulfolen genom en cheletropisk reaktion. Aktiveringsenthalpin för hetero-Diels-Alder-reaktionen är cirka 2 kcal/mol mindre än för motsvarande cheletropa reaktion. Sulfolenet är ca 10 kcal/mol stabilare än det isometriska sultinet i CH2 Cl2 /SO2 -lösning.
Författarna kunde experimentellt utarbeta en hastighetslag vid 261,2 K för reaktionen av 1,2-dimetylidencyklohexan med svaveldioxid för att ge motsvarande sulfolen. Reaktionen var av första ordningen i 1,2-dimetylidencyklohexan men av andra ordningen i svaveldioxid (se nedan). Detta bekräftade en förutsägelse som teoretiska kemister gjort på grundval av ab initio-kvantberäkningar på hög nivå. Med hjälp av beräkningsmetoder föreslog författarna en övergångsstruktur för den cheletropa reaktionen av 1,2-dimetylidencyklohexan med svaveldioxid (se figuren till höger). Reaktionen är av andra ordningen i svaveldioxid eftersom en annan molekyl av svaveldioxid sannolikt binder till övergångstillståndet för att hjälpa till att stabilisera det. Liknande resultat hittades i en studie från 1995 av Suarez, Sordo och Sordo som använde ab initio-beräkningar för att studera den kinetiska och termodynamiska kontrollen av reaktionen av svaveldioxid med 1,3-diener.
Effekter av lösningsmedel
Effekten av lösningsmedlet i den cheletropa reaktionen av 3,4-dimetyl-2,5-dihydrotiopen-1,1-dioxid (till höger) undersöktes kinetiskt i 14 lösningsmedel. Reaktionshastighetskonstanter för den framåtriktade och omvända reaktionen samt jämviktskonstanter visade sig vara linjärt korrelerade med ET (30).
Reaktionerna genomfördes vid 120 °C och studerades med 1H-NMR-spektroskopi av reaktionsblandningen. Framåtgången k1 visade sig minska med en faktor 4,5 från cyklohexan till metanol. Den omvända hastigheten k-1 visade sig öka med en faktor 53 från cyklohexan till metanol, medan jämviktskonstanten Keq minskade med en faktor 140. Det föreslås att polariteten förändras under aktiveringsprocessen, vilket framgår av sambanden mellan jämvikts- och kinetiska data. Författarna säger att reaktionen verkar påverkas av lösningsmedlets polaritet, och detta kan visas av förändringen i dipolmomenten när man går från reaktant till övergångstillstånd till produkt. Författarna uppger också att den cheletropa reaktionen inte verkar påverkas av vare sig lösningsmedlets surhet eller basicitet.
Resultaten av denna studie leder författarna till att förvänta sig följande beteenden:
1. Förändringen av lösningsmedlets polaritet påverkar hastigheten mindre än jämvikten.
2. Hastighetskonstanterna kommer att kännetecknas av motsatt effekt på polariteten: k1 kommer att minska något med ökningen av ET (30), och k-1 kommer att öka under samma förhållanden.
3. Effekten på k-1 kommer att vara större än på k .1
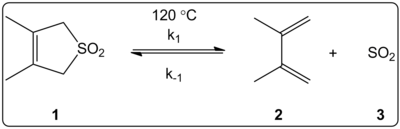
Cheletropisk reaktion studerad i olika lösningsmedel

Förslag till övergångstillstånd för reaktion av 1,2-dimetylidencyklohexan med SO2 för att ge en sulfolen genom en cheletropisk reaktion

Reaktion av 1,2-dimetylidencyklohexan med SO2 ger en sultin genom en hetero-Diels-Alder-reaktion under kinetisk kontroll eller en sulfolen genom en cheletropisk reaktion under termodynamisk kontroll.
Carbentillsatser till alkener
En av de syntetiskt viktigaste cheletropa reaktionerna är additionen av ett singulärt karben till en alken för att bilda ett cyklopropan (se figuren till vänster). Ett karben är en neutral molekyl som innehåller ett tvåvärt kol med sex elektroner i sitt valensskal. På grund av detta är karbener mycket reaktiva elektrofiler och bildas som reaktionsintermediärer. En singletkarben innehåller en tom p-orbital och en ungefärlig sp2 hybridorbital som har två elektroner. Singletkarbiner adderar stereospecifikt till alkener, och alkenens stereokemi bibehålls i cyklopropanprodukten. Mekanismen för addition av en karben till en alken är en samordnad [2+1]-cykloaddition (se figur). Karbener som härrör från kloroform eller bromoform kan användas för att addera CX2 till en alken för att ge ett dihalocyklopropan, medan Simmons-Smith-reagenset adderar CH2 .
Interaktionen mellan den fyllda karbenorbitalen och alkenens π-system skapar ett system med fyra elektroner och gynnar ett icke-linjärt tillvägagångssätt. Det är också gynnsamt att blanda karbenens tomma p-orbital med alkenens fyllda π-orbital. Gynnsam blandning sker genom ett icke-linjärt tillvägagångssätt (se figur 2 till höger). Även om teorin tydligt gynnar ett icke-linjärt tillvägagångssätt finns det dock inga uppenbara experimentella konsekvenser för ett linjärt respektive icke-linjärt tillvägagångssätt.

Figur 2. A) Orbitalerna för singulettkarbiner B) Icke-lineär metod för a) karben sp2 Orbital och b) karben p Orbital

Tillsats av ett karben till en alken för att bilda en cyklopropan
Frågor och svar
F: Vad är en cheletropisk reaktion?
S: En cheletropisk reaktion är en typ av pericyklisk reaktion där en atom på en av reagenserna får två nya bindningar.
F: Vad är en pericyklisk reaktion?
S: En pericyklisk reaktion är en reaktion som inbegriper ett övergångstillstånd med en cyklisk grupp av atomer och en tillhörande cyklisk grupp av interagerande orbitaler, där det sker en omorganisering av َ- och ً-bindningar.
F: Hur skiljer den sig från andra typer av reaktioner?
S: Cheletropiska reaktioner är en underklass av cycloadditioner, och det som skiljer dem från andra typer av reaktioner är att på en av reagenserna görs båda de nya bindningarna till samma atom.
F: Vilka är några exempel?
S: Exempel är "cheletropa extrusioner", t.ex. när den enskilda atomen i karbonylgruppen hamnar i kolmonoxid.
F: Vad driver dessa reaktioner?
S: Drivkraften för dessa reaktioner är ofta den entropiska fördelen med att frigöra en gas (t.ex. CO eller N2).
Fråga: Har figur 1 något samband med cheletropa reaktioner? S: Ja, figur 1 visar exempel på cheletropa reaktioner.
Sök
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)