Alkyner – trippelbundna kolväten: egenskaper, reaktivitet och användning
Upptäck alkyner: trippelbundna kolväten — egenskaper, reaktivitet och användningar. Lär dig om struktur, reaktioner, syntes och industriella tillämpningar.
En alkyn är en molekyl som innehåller en trippelbindning mellan två kolatomer. De har den allmänna formeln CnH2n-2 (för acykliska alkyner) och kallas ofta acetylener. Den enklaste alkynen är acetylen (etyn), C2H2. Alkyner är i allmänhet hydrofoba: de löser sig bra i organiska lösningsmedel men dåligt i vatten. Som i andra kolväteserier skiljer sig varje efterföljande medlem i homologserien från föregångaren med en -CH2-enhet.
Struktur och bindningar
Kolatomerna i en trippelbindning är sp-hybridiserade, vilket ger en i stort sett linjär geometri kring trippelbindningen. En trippelbindning består av ett σ‑bindning och två π‑bindningar. Detta ger kortare och starkare bindningar än i enkel‑ och dubbelbindningar, samt påverkar elektronfördelningen och reaktiviteten hos molekylen.
Fysiska egenskaper
Alkyner har egenskaper som liknar andra opolära kolväten: de är i stort sett olösliga i vatten men väl lösliga i organiska lösningsmedel. Kok‑ och smältpunkter ökar med molekylstorleken. Terminala alkyners C–H‑bindning är något mer sur än i alkaner (pKa ≈ 25), vilket gör att terminala alkyner kan deprotoneras av mycket starka baser.
Kemisk reaktivitet
Alkyner är ofta mer reaktiva än motsvarande alkaner och kan i många fall vara mer reaktiva än alkener beroende på reaktionstyp. Viktiga reaktioner är:
- Additionsreaktioner: Alkyner kan genomgå additionsreaktioner för att bilda alkaner eller alkener. De kan adderas till t.ex. en keton i vissa synteser.
- Hydrogenering: Fullständig hydrogenering ger alkaner. Partiell hydrogenering kan ge både cis- och trans-alkener: Lindlar‑katalysator ger vanligen cis (syn‑) addition, medan lösningsmedelsmetoder med natrium i flytande ammoniak ger ofta trans (anti‑) produkt.
- Deprotonering och acetylider: Terminala alkyners relativt sura H kan tas bort av starka baser (t.ex. NaNH2, organolithium‑reagenser) och bilda en nukleofil acetylid‑anion. Dessa används flitigt för att skapa nya kol‑kol‑bindningar (alkynylation) och i substitutionsreaktioner.
- Hydratisering och hydroboration: Acid‑katalyserad hydratisering (ofta HgSO4) ger i allmänhet ketoner (Markovnikov‑addition). Hydroboration‑oxidation av terminala alkyner ger vanligen aldehyder (anti‑Markovnikov‑omvandling).
- Halogenering och additionsreaktioner: Addition av halogener eller halogenvatten leder till di‑ eller tetrahalogenerade produkter beroende på förhållanden.
- Pericykliska och cyklerande reaktioner: Alkyner kan delta i olika pericykliska reaktioner och cyklotrimeriseringar (t.ex. till aromatiska system) och i "click‑kemier" som 1,3‑dipolära cykloadditioner (t.ex. med azider till triazoler).
Framställning
Alkyner framställs i laboratorium och industri på flera sätt. Ett vanligt labb‑sätt är eliminering av dihalogenider (tvåstegs dehydrohalogenering) för att bilda trippelbindning. Acetylen framställs industriellt till exempel genom hydrolys av kalciumkarbid:
CaC2 + 2 H2O → C2H2 + Ca(OH)2
Användning
Alkyner är viktiga byggstenar i organisk syntes och används som:
- Intermediärer i syntes av läkemedel, naturliga produkter och finkemikalier.
- Råmaterial i kopplingsreaktioner (t.ex. Sonogashira‑koppling) för att bygga konjugerade system och material med elektroniska egenskaper.
- Acetylen används historiskt och fortfarande i vissa sammanhang i svetsning och skärning (oxy‑acetylen) tack vare sin höga flampunkt och temperatur.
- Komponenter i polymerer, organiska halvledare och ytkemiska applikationer.
- Användning i "click chemistry" (t.ex. alkyner + azider → triazoler) för biokonjugering och materialsyntes.
Säkerhet
Alkyner, särskilt acetylen, är mycket brandfarliga och kan vara explosiva under vissa tryck‑ och temperaturförhållanden. Acetylen bör inte komprimeras övertryck i standardbehållare utan särskild hantering eftersom den kan sönderfalla explosivt. God ventilation, antändningsskydd och korrekt lagring samt hantering med rekommenderade tryckreglerare och lösningsmedel är viktiga för säkerheten.
Sammanfattningsvis är alkyner en mångsidig klass kolväten med karakteristisk trippelbindning, linjär struktur och rik reaktivitet som gör dem ovärderliga i både grundforskning och industriell kemi.
Struktur
Alkyner har en 180 graders vinkel mellan de två kolatomerna. Därför gillar de inte att ingå i en cyklisk förening. Några exempel på alkyner visas nedan.
| Funktionella grupper |
|
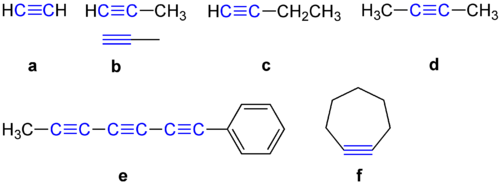
Exempel på alkyner
Frågor och svar
F: Vad är en alkan?
S: En alkan är en molekyl som har en trippelbindning mellan två kolatomer.
F: Vad är den allmänna formeln för alkyner?
S: Den allmänna formeln för alkyner är CnH2n-2.
Fråga: Vad är den minsta alkynen?
S: Den minsta alkynen är acetylen, även kallat etyne.
Fråga: Är alkyner hydrofoba eller hydrofila?
Svar: Alkyner är hydrofoba, vilket innebär att de löser sig bra i organiska lösningsmedel men inte i vatten.
F: Hur skiljer sig de på varandra följande medlemmarna i en alkyn från varandra?
S: Varje alkanmedlem skiljer sig åt i sin molekylära formularitet med "-CH2".
Fråga: Är alkiner mer reaktiva än vanliga kolväten?
Svar: Ja, alkyner är mer reaktiva än vanliga kolväten, t.ex. alkener, i många reaktioner.
Fråga: Vad kan man göra med en alkyn i slutet av en molekyl?
S: Om alkynen befinner sig i slutet av en molekyl kan den lätt avlägsnas genom protonering med en stark bas och sedan användas i additionsreaktioner, t.ex. som tillsats till en keton.
Sök